ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 80
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Сутегi атомында ядроның кулондық өрiсiнде қозғалатын бiр электрон болады. Осы электронның стационарлық энергия мәндерi (деңгейлерi) тек n бас кванттық сан мәнiне тәуелдi болатындығы кванттық механикада көрсетiледi.
Сiлтiлiк металл атомдары ядродан, iшкi қабықшалардағы электрондардан және бiр сыртқы (валенттiк) электроннан тұратын жүйе болып табылады. Қалған (z-1) электрондар ядромен бiрге орнықты атомдық «қалдық» құрап тұрады. Осындай электрондық жүйе атомдық «қалдық» өрiсiнде әлсiз байланысқан электрон қозғалатын «сутегi тәрiздi» жүйе ретiнде қарастырылады. Атомдық «қалдық» тудыратын ұйтқытуды ескерiп осындай сутегi тәрiздi жүйелердiң энергетикалық деңгейлерiн анықтау энергия мәндерi тек n бас кванттық санға ғана тәуелдi емес, валенттiк электронның орбиталық кванттық санына да тәуелдi болатындығын көрсетедi, сонымен Е=En.
Сiлтiлiк металл атомының валенттiк электроны
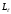 орбиталық импульс моментiнен басқа
орбиталық импульс моментiнен басқа 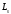 меншiктi импульс моментi болады, ал
меншiктi импульс моментi болады, ал электронның толық импульс моментi
 осы моменттердiң қосындысы болып табылады. Моменттердi қосу кванттық заңдар бойынша iске асырылады, Lj шамасы тек дискреттi мәндер қабылдай алады:
осы моменттердiң қосындысы болып табылады. Моменттердi қосу кванттық заңдар бойынша iске асырылады, Lj шамасы тек дискреттi мәндер қабылдай алады: 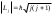 , мұндағы j-iшкi кванттық сан, +s, -s мәндер қабылдайды. =0болғанда j=1/2 тек бiр мән қабылдайды. нөлден өзгеше болғанда, j-дiң екi мәнi болады: j=1/2.
, мұндағы j-iшкi кванттық сан, +s, -s мәндер қабылдайды. =0болғанда j=1/2 тек бiр мән қабылдайды. нөлден өзгеше болғанда, j-дiң екi мәнi болады: j=1/2.Электрондардың механикалық импульс моменттерiмен магниттiк дипольдық моменттер байланысқандығы белгiлi, бұлар бiрiмен-бiрi тогы бар екi контур сияқты әсерлеседi. Осы әсерлесу энергиясы орбиталық және спиндiк магниттiк моменттердiң өзара бағдарлануына байланысты болады. Демек, jмәнi әртүрлі күйлердiң энергиялары да әртүрлі болуға тиiс. Энергияның стационарлық мәндерiн спин-орбиталық әсерлесудi ескерiп табу есебiн кванттық механикалық шешу энергия мәндерi ендi n, , jүш кванттық сандарына тәуелдi болатындығын көрсетедi, демек E=Enj.. Осы теориялық нәтиже тәжiрибеде жақсы расталады.
К
87
өп электронды атомдар үшін толық орбиталық және спиндiк импульс моменттерi жеке электрондардың импульс моменттерiнен қосылады. Осы жағдайда тұйықталған қабықшалар (электрондармен толтырылған) үшін импульстың қосынды моментi нөлге тең болады. Бүтiндей алғанда атом толмаған электрондық қабықшалардағы электрондардың (мысалы, валенттiк) қосынды импульс моментiмен сипатталады.
Валенттiк электрондардың орбиталық және спиндiк импульс моменттерi кеңiстiктiк квантталудың (векторлардың өзара орналасуы) кванттық-механикалық заңдары бойынша, толық импульс моментiнiң
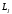 қосынды векторын құрап, қосылады. Осындай қосу нәтижесi қосындылау ретiне тәуелдi болады. Әдетте екi модельдiк жағдай қарастырылады.
қосынды векторын құрап, қосылады. Осындай қосу нәтижесi қосындылау ретiне тәуелдi болады. Әдетте екi модельдiк жағдай қарастырылады.-
Алдымен валенттiк электрондардың жеке орбиталық және спиндiк моменттерi қосылады: атомның толық орбиталық және толық спиндік моменттері анықталады, бұдан кейiн қосынды импульс моментi анықталады (LS-байланыс, Рассель-Саундерс байланысы); -
Алдымен әрбiр электронның орбиталық және спиндiк импульс моменттерi қосылады, бұдан кейiн барлық электрондар бойынша қосынды табылады (jj-байланыс).
Тәжiрибеде алынған спектрлердi талдау қосындаудың қандай ретi iске асатындығын, демек қандай байланыс берiк (әртүрлі электрондардың спиндерiнiң байланысы ма, әлде әрбiр электронның спиндiк және орбиталық моменттерiнiң байланысы ма) екендiгiн анықтауға мүмкіндiк бередi. Көпшiлiк жағдайда (электрон саны көп емес атомдар үшін) байланыстың бiрiншi түрі (LS-байланыс) орын алады.
9.1-суретте екi валенттiк электроны бар атомның LS-байланысы жағдайында орбиталық және спиндiк импульс моменттерi қосылуының векторлық схемасы келтiрiлген. Осындай атомның қорытқы импульс моменттерiнiң сандық мәндерi мына өрнектермен анықталады
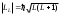 ; L=1+2, 1+2-1,...1-2;
; L=1+2, 1+2-1,...1-2;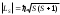 ; S=s1+s2, s1-s2;
; S=s1+s2, s1-s2; ; J=L+S, L+S-1,...,L-S (9.1)
; J=L+S, L+S-1,...,L-S (9.1)м
88
ұндағы 1 және 2, s1 және s2-валенттiк электрондардың орбиталық және спиндiк кванттық сандары. Екi валенттiк электроны бар атом үшін S=0немесе 1 бола алады, ал LSекi мән қабылдайды: LS=0 және
 .
.Атомның Jкванттық сан мәнi әртүрлі күйлерi орбиталық және спиндiк импульс моменттерiнiң әртүрлі өзара бағдарлануларына сәйкес келедi. Мұндай күйлер сондықтан әртүрлі энергиямен сипатталады.

Сурет 9.1 Екi валенттiк электроны бар атомның LS-байланысы жағдайында орбиталық және спиндiк импульс моменттерi қосылуының векторлық схемасы
(9.1) өрнектен, L және S берiлген жағдайда J-дiң әртүрлі мәндерiнiң саны (2s+1) – ге тең болатындығы көрiнедi. Бұл L, S мәндерi берiлген және L>S болған жағдайда, атомның энергия деңгейi (2S+1) деңгейшеге жiктелетiндiгiн бiлдiредi.
Деңгейшелер саны мультиплеттiк деп аталады. Екi электроннан тұратын жүйеде s=0 және s=1, демек, мультиплеттiк 1 және 3-ке тең бола алады, дара деңгейлер (синглеттер) және триплеттiк деңгейлер түзіледi. Энергия деңгейлерiнiң мультиплеттiгiнен атомның шығару спектрiндегi сызықтардың өзара орналасуында өзiне тән заңдылықтар пайда болады. Спектрлердi талдау ең алғаш атомдардың энергетикалық деңгейлерiнiң салыстырмалы орналасуы, және атомдардың электрондық құрылымы жөнiнде деректер алуға, және де энергетикалық деңгейлердiң мультиплеттiк түзілiсiн электронның өзiне тән, өзгеше және елеулi қасиетi-спиндiк импульс моментiмен байланыстыруға мүмкіндiк бердi.
Ж
89
ұмыста Cd, Hg, Znатомдары буларының сәуле шығару спектрi зерттеледi. Cd, Hg, Znатомдарының сыртқы электрондық қабықшасында екi электрон болады, iшкi қабықшалардың қорытқы
 және
және импульс моменттерi нөлге тең.
импульс моменттерi нөлге тең.9.2-суретте гелий атомының энергетикалық деңгейлер схемасы және бұлардың арасында мүмкін болатын ауысулар келтiрiлген. Қалыпты (негiзгi) күйде сыртқы электронның екеуi де 6s-электрондар болып табылады, өйткенi бұлардың бас кванттық сандары n=6, ал орбиталық кванттық сандары 0.Электрондардың бiреуi әрқашан қозбаған 6s-күйде қалып қояды, ал екiншiсi кванттық сандары өзгерiп, қоздырылады. 10күйiнде қалатындықтан, қорытқы Lсаны 2-мен дәл келедi. Қорытқы спиндiк импульс моментi, жоғарыда айтылғандай, s=0 және s=1 болады.
Көп электронды атомдардағы спектрлiк сызықтардың пайда болуына жауапты электрондардың энергетикалық деңгейлерiн (күйлерiн)
 термдермен сипаттайды, мұндағы LS, P, D,... (L=0, 1, 2,...cандары үшін). Терм белгiсiндегi жоғарғы сол жақтағы индекс деңгейдiң мультиплеттiгiн, төменгi оң жақтағы индекс-
термдермен сипаттайды, мұндағы LS, P, D,... (L=0, 1, 2,...cандары үшін). Терм белгiсiндегi жоғарғы сол жақтағы индекс деңгейдiң мультиплеттiгiн, төменгi оң жақтағы индекс-
Jсанын анықтайды.
9.1-кесте
| 1-элек трон | 2-элек трон | L | S=0 | S=1 | |||
| | | | J | терм | J | Терм | |
| 6s | 6s | 0 | 0 | 1S0 | 1 | 3S1 | |
| 6s | 6p | 1 | 1 | 1P1 | 0,1,2 | 3P0; 3P1; 3P2 | |
| 6s | 7s | 0 | 0 | 1S0 | 1 | 3S1 | |
| 6s | 7p | 1 | 1 | 1P1 | 0,1,2 | 3P0; 3P1; 3P2 | |
| 6s | 6d | 2 | 2 | 1D2 | 1,2,3 | 3D1; 3D2; 3D3 | |
90

Сурет 9.2 Гелий атомының энергия деңгейлерінің диаграммасы
және мүмкін болатын көшулер
С
91
ынап атомының мүмкін күйлерi 9.1-кестеде келтiрiлген.
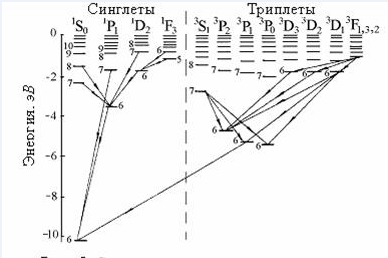
Сурет 9.3 Сынап атомының энергия деңгейлерінің диаграммасы
және мүмкін болатын көшулер
9.3-суретте тiк бағытта сынап атомының толық энергиясы салынған. Атом энергиясының нөлдiк мәнiне атомнан бiр электронды бөлiп алуға сәйкес энергия алынған, сондықтан атом энергиясы терiс болады. 6, 7, 8... сандары валенттiк электронның n=1,2,3,4,5
қабықшаларда сынап атомының 78 iшкi электроны орналасқан. Бұл электрондар оптикалық спектрдiң шығарылуына қатыспайды. Сынап атомыныңқалыпты (негiзгi) күйiне сәйкес энергия деңгейi (61S0) 10,43 эВ тереңде жатыр; бұл сынап атомының иондану жұмысы 10,43 эВ болады деген мағына бiлдiредi. 9.3-суретте деңгейлер арасындағы мүмкін кванттық ауысулар да кескiнделген (ауысулар кезiнде L=1, J=0,1 кванттық-механикалық сұрыптау ережелерi орындалады).
Сынап атомының сипаттаушы спектрлiк сызықтары мына кванттық ауысуларға сәйкес келедi:
6 3Р1 61S0-=253,7нм; 7 3S1 6 3Р1 -2=435,8нм;
7 3S1 6 3Р0 -1=546,1нм; 7 3S 6 3Р2 -3=404,7нм;
М
92
ырыш, кадмий, сынап атомдарының спектрлерi бiрiне-бiрi ұқсас. L және S сандары берiлгенде энергияның Jкванттық санына тәуелдiлiгi триплеттiк жiктелудiң шамасын анықтайды: үлкен атомдық нөмiрлер үшін жiктелу шамасы үлкен болады. Егер тиiстi спектрлiк сызықтардың толқын ұзындықтары анықталған болса, онда атомдардың энергетикалық деңгейлер схемасын тұрғызуға болады. Жұмыста мырыш, кадмий, сынап триплетiнiң спектрлiк сызықтары толқын ұзындықтарын тауып және өлшеу керек.

Сурет 9.3 Сынап спектрі
9.4. Жұмыстың орындалуы
-
Сынап лампасын жағып, УМ-2 монохроматоры саңылауының жарықтануын тексеру. -
УМ-2 монохроматорының градуирлiк графигiн сынап спектрi бойынша тұрғызу (немесе бар графиктi тексеру):барабанның градустық бөлiктерiн толқын ұзындықтарға сәйкес келтiрiп график тұрғызу немесе бар графиктi тексеру. -
Мырыш спектрiн бақылау. УМ-2 барабанын шкала басынан бастап аяғына қарай бұрап, спектрдiң әрбiр сызығын окулярдың көру өрiсiндегi көрсеткiшке дәл келтiрiп, бұған сәйкес барабан бөлiгiн жазып алу. Дәл осылай кадмий, сынап спектрiне бақылау жүргізiледi. Бақылау нәтижелерiн кестеге толтыру.
-
Градуирлеу графигiн және 9.3-суретті пайдаланып, барлық бақыланған сызықтардың толқын ұзындықтарын анықтау, бұлардың мәндерiн кестеге толтыру.
-
Мырыш, сынап, кадмий триплеттерi спектрлiк сызықтарының толқын ұзындықтарын анықтау. -
9.2-кестенi пайдаланып Hg (n=6), Cd (n=5), Zn (n=4) атомдары үшін n1S0, (n+1)3S1, n3P0, n3P1, n3P2деңгейлерiнiң орналасу схемасын сызу (толық схема бөлiктерi).


