ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 81
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2sпен 2pдеңгейлерi бiр-бiрiнен күштi алшақ орналасқан; 3s, 3pжәне 3dдеңгейлерiнiң алшақтауы аздау және сутегi деңгейлерiне жақын орналасады (әсiресе 3pжәне 3d); ең соңында 4pжәне 4dдеңгейлерi өзара бiрiмен-бiрi және сутегi деңгейлерiмен дәл келедi деуге болады.
7.3.4. Сiлтiлiк металдар спектрлерi. Сiлтiлiк металл атомдарының шығару спектрлерi, сутегi атомының спектрi сияқты, көптеген спектрлiк сызықтардан тұрады.
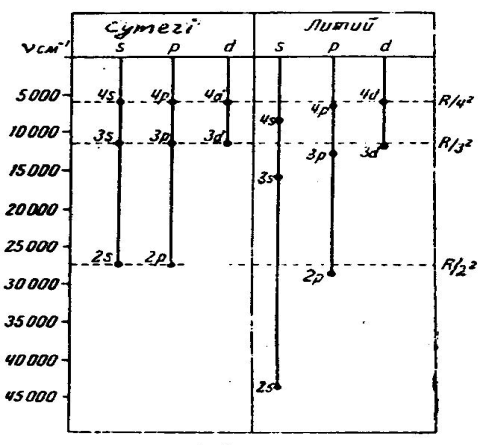
Сурет 7.4 Литийдiң термдерi мен сутегi термдерiн салыстыру
Осы спектрлiк сызықтарды мұқият жүйелеу нәтижесiнде бұларды әрқайсысы қоздырылған атомның қандай да бiр белгiлi деңгейге ауысуымен байланысты серияларға топтастыру мүмкін болады.
А
69
томның мүмкін болатын стационарлық күйлерiнiң жиынтығын энергетикалық деңгейлер диаграммасы (схемасы) түрінде кескiндеу қолданылады. 7.5-7.7-суреттерде Li, Na, K атомдарының энергетикалық деңгейлер диаграммалары келтiрiлген. Бұларда электрон бiр энергетикалық күйден басқасына ауысқан кезде атом шығаратын немесе жұтатын кейбiр спектрлiк сызықтардың толқын ұзындықтары көрсетiлген.
Сiлтiлiк металдар иондарының спектрлерiн зерттеу атомдық қалдықтың (яғни ядро және (z-1) электронның) импульс моментi нөлге тең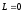 болатынын көрсеттi. Демек, сiлтiлiк металл атомының орбиталық моментi оның сыртқы электронының моментiне тең болады және кванттық санымен анықталады:
болатынын көрсеттi. Демек, сiлтiлiк металл атомының орбиталық моментi оның сыртқы электронының моментiне тең болады және кванттық санымен анықталады: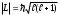 .
.
Сұрыптау ережесi. Сәуле шығару (және жұту) сыртқы электронның бiр деңгейден басқа деңгейге ауысу нәтижесiнде iске асады. Бiрақ ауысулардың барлығы мүмкін болмайды екен. Мүмкін болатыны тек сыртқы электронның орбиталық кванттық саны бiрге өзгеретiн
1 (7.11)
жағдайлардағы ауысулар ғана екен. Бұл ұрықсат етiлген ауысулар тек s-және p-күйлер арасында, p-және d-күйлер арасында d-және f-күйлер арасында болады деген мағына бередi. Бұл жағдайларда n бас кванттық сан кез-келген бүтін санға өзгере алады.
Кванттық теория тұрғысынан сұрыптау ережелерi бiр кванттық күйден басқа бiр кванттық күйге ауысу ықтималдығымен байланысты болады. Сонда сұрыптау ережелерi тиым салатын ауысулардың ықтималдығы iс жүзінде нөл болады екен.
Спектрлiк сериялар. (7.4) сұрыптау ережелерiне сүйенiп литий атомдары спектрiнде мына сериялардың байқалатындығын оңай түсіндiруге болады:
–бас серия: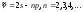
–
70
айқын серия: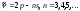
Сурет 7.5 Литий атомының энергетикалық деңгейлерінің схемасы
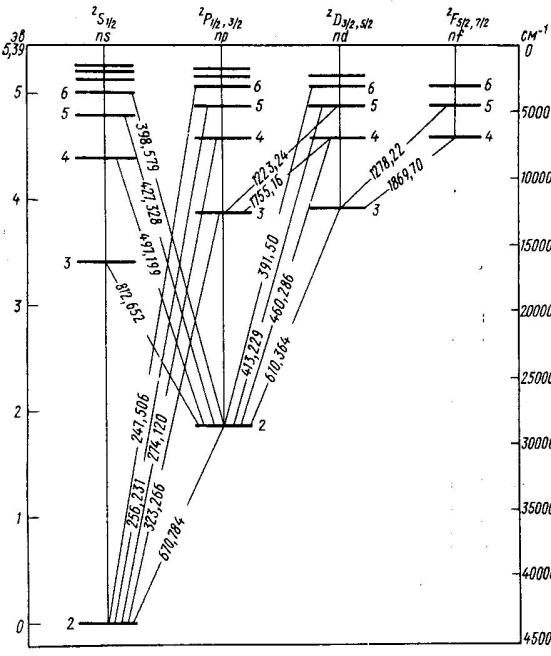
Сурет 7.6 Натрий атомының энергетикалық деңгейлерінің схемасы
71
65
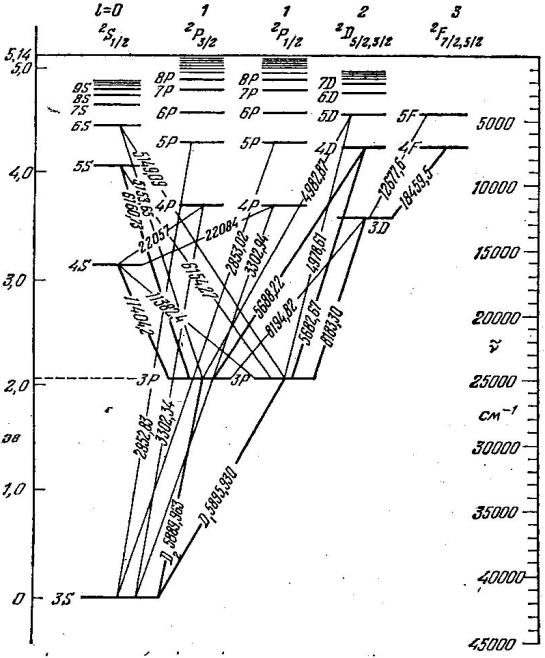
Сурет 7.7 Калий атомының энергетикалық деңгейлерінің схемасы
–диффузиялық серия: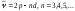 (7.12)
(7.12)
–iргелi, немесе
Бергман сериясы: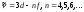
мұндағы -шығарылатын сызықтың толқындық саны. Бас серияның
-шығарылатын сызықтың толқындық саны. Бас серияның 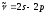 ауысуына сәйкес келетiн спектрлiк сызығының интенсивтiгi ең жоғары болады. Осы сызықты резонанстық деп атайды.
ауысуына сәйкес келетiн спектрлiк сызығының интенсивтiгi ең жоғары болады. Осы сызықты резонанстық деп атайды.
(7.12) өрнектерiнде сериялар символдық түрде жазылған. Айқын түрде бұларды екi тиiстi термнiң айырымы түрінде жазады. Мәселен, литийдiң бас сериясы былай жазылады:
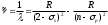 , n=2, 3, 4,... (7.13)
, n=2, 3, 4,... (7.13)
Б
72
асқа серияларды да осы сияқты жазуға болады. Ескеретiн нәрсе, кванттық ақау (немесе ридбергтiк түзетулер =-e) әрбiр серия аумағында iс жүзінде тұрақты болады да, ал бiр сериядан басқа серияға ауысқанда өзгередi.
7.4. Жұмыстың орындалу ретi
1.ДСП-1 немесе ПС-18 спектропроекторында спектрлiк сызықтар атласы көмегiмен алынған спектрограмманы зерттеу: спектрлерден сiлтiлiк элементтер сызықтарының толқын ұзындығын анықтау. Табылған сызықтарды серияларға топтастыру. Алынған нәтижелердi7.2-кестеге толтыру керек.
7.2-кесте
2. Алынған нәтижелерді сiлтiлiк металл атомының кейбiр маңызды параметрлерiн анықтау үшін қолдануға болады мүмкін. Сериялардың жоғарғы деңгейлерiнiң n тиiмдi кванттық сандарын және кванттық ақауларды анықтау. Нәтижелердi өңдеудi спектрлiк сызықтардың толқындық сандарын есептеуден бастау керек.
толқындық сандарын есептеуден бастау керек.
3.Сiлтiлiк металл атомының (мысалы Na) стационарлық күйлерi энергиясын эВ -та есептеу. Алдымен, d-күйлерiнiң сутегi тәрiздiлiгiн (d0) (7.7а) формуласы бойынша деңгейлерiнiңEnd энергиясын табу. Бұдан кейiн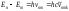 Бордың жиiлiктер ережесi және атомның кванттық ауысулар схемасы (7.6-сурет) көмегiмен тиiстi hv мәндерiн қолданып 3Pжәне 3Sдеңгейлерi энергияларын табу. Дәл осылай 5Sжәне 6S деңгейлерi энергиялары табылады.
Бордың жиiлiктер ережесi және атомның кванттық ауысулар схемасы (7.6-сурет) көмегiмен тиiстi hv мәндерiн қолданып 3Pжәне 3Sдеңгейлерi энергияларын табу. Дәл осылай 5Sжәне 6S деңгейлерi энергиялары табылады.
Алынған нәтижелердi - E3S, E5S, E6S, E3p мәндерiн (7.7а) формулаға қойып, 3S, 5S, 6S , 3Р кванттық ақаулары есептелiнедi. 3S, 5S, 6Sақаулары мәндерiнiң бiр-бiрiнен айырмашылығы болмашы болатынын ескертемiз. Бұлар 4S, 7S, 8S, 4P -8P деңгейлерiнiң EnS және EnP энергияларын есептегенде пайдаланылады. Энергияны есептеулердi эВ-тың жүздiк бөлiгiне дейiнгi дәлдiкпен жүргiзу керек.
4. Алынған нәтижелер бойынша сiлтiлiк металл атомының энергетикалық деңгейлер схемасын тұрғызу (0,5 эВ/см масштабында). Тәжiрибеде байқалған сызықтарға сәйкес схемада кванттық ауысуларды көрсету. Энергия деңгейлерiнiң схемасы бойынша сiлтiлiк металл атомының негiзгi күйден иондану энергиясын табу.
(7.7б), (7.7а) формулалары бойынша атомдық қалдықтың
s-, p-, d- және f-күйлерiндегi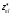 тиiмдi зарядын анықтау.
тиiмдi зарядын анықтау.
5
73
. Сiлтiлiк металл атомының бас, айқын, диффуздық және iргелi сериялары үшін фотондардың минимум және максимум энергиясын, максимум және минимум толқын ұзындығын, минимум және максимум толқындық сандарын табу.
Бақылау сұрақтары
–негiзгi деңгейдi анықтай бiлу;
–энергетикалық деңгейлер схемасын сыза бiлу;
–байқалатын барлық сериялар үшін кванттық ауысуларды көрсете бiлу;
–қабылданған белгiлеу бойынша әрбiр сериядағы кванттық ауысуларды жаза бiлу.
74
8. НАТРИЙ СПЕКТРЛІК СЫЗЫҚТАРЫНЫҢ НӘЗІК
ТҮЗІЛІСІН ЗЕРТТЕУ
8.1.Жұмыстың мақсаты мен мазмұны
Сiлтiлiк элементтер атомдарының энергетикалық деңгейлерi сызықтарының нәзiк түзілiсiмен танысу. Натрий атомының спектрлiк сызықтарының дублеттiк түзілiсiн тәжiрибелiк зерттеу. Дисперсиясы үлкен спектрографта (ДФС-8) натрий спектрiн алу. Спектрлiк сызықтардың нәзiк түзілiсi құраушыларының ара қашықтығы. Осы деректер бойынша натрий атомы Р-термдерiнiң жiктелу шамасын және осы жiктелу шамасының n бас кванттық сан мәндерiне тәуелдiлiгiн анықтау. а экрандау тұрақтысын анықтау.
8.2. Аппаратура
ДФС-8 спектрографы, УГЭ-4 генераторы.
8.3. Теориялық кiрiспе
Сiлтiлiк металл атомдарының спектрлiк сызықтарын ажыратқыштық қабілетi жоғары құралдармен зерттегенде осы сызықтардың әрқайсысы қос сызықтан (дублет) тұратындығы - күрделi екендiгi ашылды. Сызықтардың осылай құраушыларға жiктелуi спектрдiң
нәзiк түзілiсi деп аталады. Жақын орналасқан бiрнеше құраушылардан тұратын спектрлiк сызықтарды мультиплеттер деп атайды. Әр түрлі атомдардың мультиплеттегi құраушылар саны екiге (дублет), үшке (триплет), төртке (квартет) және т.т. тең болуы мүмкін; дара спектрлiк сызықтар да болады, бұлар синглеттер деп аталады.
Сiлтiлiк металл атомдарының спектрлiк сызықтарыныңәрқайсысы екiқұраушыдан тұрады және бұлардың аралары литийде өте жақын, ал атомдық массалары артқан сайын аралары алшақтай беретiндiгi тағайындалған. Мәселен, резонанстық сызықтың жiктелу шамасы (, нм) төмендегiдей болады.
Спектрлiк сызықтардың жiктелуi, араларында кванттық ауысулар болатын энергия деңгейлерiнiң жiктелуiмен байланысты болуға тиiс. Басқаша айтқанда спектрлiк сызықтың нәзiк түзілiсi электронның энергия деңгейлерiнiң нәзiк түзілiсiмен байланысты болуға тиiс.
С
75
iлтiлiк металдар атомдарының энергетикалық спектрiн қарастырайық.
8.3.1.Сiлтiлiк металдар атомдарының энергетикалық спектрi
Сiлтiлiк металл атомы ядроның кулондықөрiсiндегi көп электрондар жүйесi болғандықтан мұның энергетикалық спектрiн есептеу қиын әрi күрделi болып табылады. Сондықтан мынадай әдiс қолданылады-есептеудi жеңiлдететiн ұйғарым жасалады: атомның iшкi қабатындағы электрондар ядроға жақын орналасқан (ядро және iшкi қабаттардағы электрондар атомдыққалдықтүзеп тұрады), ал атоммен әлсiз байланысқан сыртқы электрон, керiсiнше, ядродан жеткiлiктi үлкенқашықтықта болады деп ұйғарып, сiлтiлiк металл атомы сутегi тәрiздi жүйе ретiнде қарастырылады (сыртқы электрон-атомдық қалдық). Осылай қарастырғанда, сыртқы электронның атомның қалған электрондарымен әсерлесуi, атомдық қалдықтың сыртқы электронды кулондық тартылысына қабаттасатын болмашы ұйытқу ретiнде ескерiледi; ал осы жағдайдағы атом энергиясы үшін сутегi атомының энергия өрнегiне ұқсас өрнек алынады;
 (8.1)
(8.1)
мұндағы n=(n-
7.3.4. Сiлтiлiк металдар спектрлерi. Сiлтiлiк металл атомдарының шығару спектрлерi, сутегi атомының спектрi сияқты, көптеген спектрлiк сызықтардан тұрады.

Сурет 7.4 Литийдiң термдерi мен сутегi термдерiн салыстыру
Осы спектрлiк сызықтарды мұқият жүйелеу нәтижесiнде бұларды әрқайсысы қоздырылған атомның қандай да бiр белгiлi деңгейге ауысуымен байланысты серияларға топтастыру мүмкін болады.
А
69
томның мүмкін болатын стационарлық күйлерiнiң жиынтығын энергетикалық деңгейлер диаграммасы (схемасы) түрінде кескiндеу қолданылады. 7.5-7.7-суреттерде Li, Na, K атомдарының энергетикалық деңгейлер диаграммалары келтiрiлген. Бұларда электрон бiр энергетикалық күйден басқасына ауысқан кезде атом шығаратын немесе жұтатын кейбiр спектрлiк сызықтардың толқын ұзындықтары көрсетiлген.
Сiлтiлiк металдар иондарының спектрлерiн зерттеу атомдық қалдықтың (яғни ядро және (z-1) электронның) импульс моментi нөлге тең
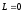 болатынын көрсеттi. Демек, сiлтiлiк металл атомының орбиталық моментi оның сыртқы электронының моментiне тең болады және кванттық санымен анықталады:
болатынын көрсеттi. Демек, сiлтiлiк металл атомының орбиталық моментi оның сыртқы электронының моментiне тең болады және кванттық санымен анықталады: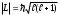 .
.Сұрыптау ережесi. Сәуле шығару (және жұту) сыртқы электронның бiр деңгейден басқа деңгейге ауысу нәтижесiнде iске асады. Бiрақ ауысулардың барлығы мүмкін болмайды екен. Мүмкін болатыны тек сыртқы электронның орбиталық кванттық саны бiрге өзгеретiн
1 (7.11)
жағдайлардағы ауысулар ғана екен. Бұл ұрықсат етiлген ауысулар тек s-және p-күйлер арасында, p-және d-күйлер арасында d-және f-күйлер арасында болады деген мағына бередi. Бұл жағдайларда n бас кванттық сан кез-келген бүтін санға өзгере алады.
Кванттық теория тұрғысынан сұрыптау ережелерi бiр кванттық күйден басқа бiр кванттық күйге ауысу ықтималдығымен байланысты болады. Сонда сұрыптау ережелерi тиым салатын ауысулардың ықтималдығы iс жүзінде нөл болады екен.
Спектрлiк сериялар. (7.4) сұрыптау ережелерiне сүйенiп литий атомдары спектрiнде мына сериялардың байқалатындығын оңай түсіндiруге болады:
–бас серия:
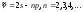
–
70
айқын серия:
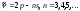

Сурет 7.5 Литий атомының энергетикалық деңгейлерінің схемасы

Сурет 7.6 Натрий атомының энергетикалық деңгейлерінің схемасы
71
65

Сурет 7.7 Калий атомының энергетикалық деңгейлерінің схемасы
–диффузиялық серия:
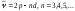 (7.12)
(7.12)–iргелi, немесе
Бергман сериясы:
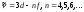
мұндағы
 -шығарылатын сызықтың толқындық саны. Бас серияның
-шығарылатын сызықтың толқындық саны. Бас серияның 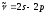 ауысуына сәйкес келетiн спектрлiк сызығының интенсивтiгi ең жоғары болады. Осы сызықты резонанстық деп атайды.
ауысуына сәйкес келетiн спектрлiк сызығының интенсивтiгi ең жоғары болады. Осы сызықты резонанстық деп атайды.(7.12) өрнектерiнде сериялар символдық түрде жазылған. Айқын түрде бұларды екi тиiстi термнiң айырымы түрінде жазады. Мәселен, литийдiң бас сериясы былай жазылады:
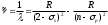 , n=2, 3, 4,... (7.13)
, n=2, 3, 4,... (7.13)Б
72
асқа серияларды да осы сияқты жазуға болады. Ескеретiн нәрсе, кванттық ақау (немесе ридбергтiк түзетулер =-e) әрбiр серия аумағында iс жүзінде тұрақты болады да, ал бiр сериядан басқа серияға ауысқанда өзгередi.
7.4. Жұмыстың орындалу ретi
1.ДСП-1 немесе ПС-18 спектропроекторында спектрлiк сызықтар атласы көмегiмен алынған спектрограмманы зерттеу: спектрлерден сiлтiлiк элементтер сызықтарының толқын ұзындығын анықтау. Табылған сызықтарды серияларға топтастыру. Алынған нәтижелердi7.2-кестеге толтыру керек.
7.2-кесте
| элемент | , нм | кванттық ауысу | серия |
| | | | |
2. Алынған нәтижелерді сiлтiлiк металл атомының кейбiр маңызды параметрлерiн анықтау үшін қолдануға болады мүмкін. Сериялардың жоғарғы деңгейлерiнiң n тиiмдi кванттық сандарын және кванттық ақауларды анықтау. Нәтижелердi өңдеудi спектрлiк сызықтардың
 толқындық сандарын есептеуден бастау керек.
толқындық сандарын есептеуден бастау керек.3.Сiлтiлiк металл атомының (мысалы Na) стационарлық күйлерi энергиясын эВ -та есептеу. Алдымен, d-күйлерiнiң сутегi тәрiздiлiгiн (d0) (7.7а) формуласы бойынша деңгейлерiнiңEnd энергиясын табу. Бұдан кейiн
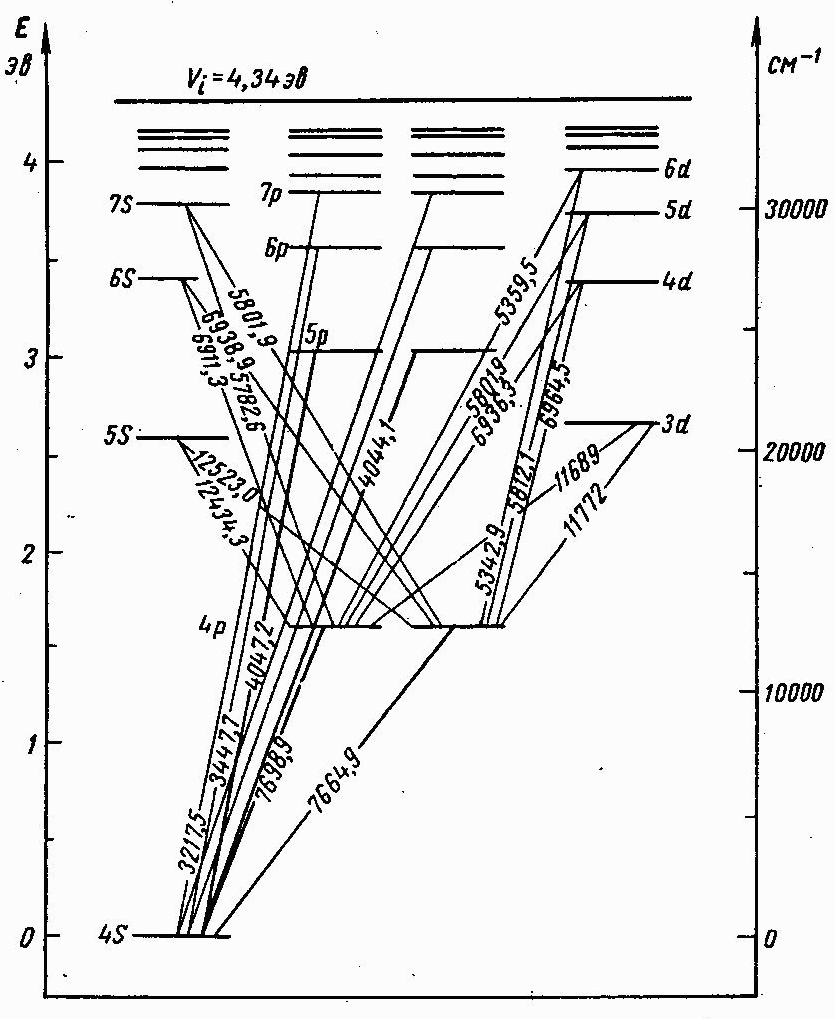
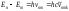 Бордың жиiлiктер ережесi және атомның кванттық ауысулар схемасы (7.6-сурет) көмегiмен тиiстi hv мәндерiн қолданып 3Pжәне 3Sдеңгейлерi энергияларын табу. Дәл осылай 5Sжәне 6S деңгейлерi энергиялары табылады.
Бордың жиiлiктер ережесi және атомның кванттық ауысулар схемасы (7.6-сурет) көмегiмен тиiстi hv мәндерiн қолданып 3Pжәне 3Sдеңгейлерi энергияларын табу. Дәл осылай 5Sжәне 6S деңгейлерi энергиялары табылады. Алынған нәтижелердi - E3S, E5S, E6S, E3p мәндерiн (7.7а) формулаға қойып, 3S, 5S, 6S , 3Р кванттық ақаулары есептелiнедi. 3S, 5S, 6Sақаулары мәндерiнiң бiр-бiрiнен айырмашылығы болмашы болатынын ескертемiз. Бұлар 4S, 7S, 8S, 4P -8P деңгейлерiнiң EnS және EnP энергияларын есептегенде пайдаланылады. Энергияны есептеулердi эВ-тың жүздiк бөлiгiне дейiнгi дәлдiкпен жүргiзу керек.
4. Алынған нәтижелер бойынша сiлтiлiк металл атомының энергетикалық деңгейлер схемасын тұрғызу (0,5 эВ/см масштабында). Тәжiрибеде байқалған сызықтарға сәйкес схемада кванттық ауысуларды көрсету. Энергия деңгейлерiнiң схемасы бойынша сiлтiлiк металл атомының негiзгi күйден иондану энергиясын табу.
(7.7б), (7.7а) формулалары бойынша атомдық қалдықтың
s-, p-, d- және f-күйлерiндегi
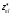 тиiмдi зарядын анықтау.
тиiмдi зарядын анықтау.5
73
. Сiлтiлiк металл атомының бас, айқын, диффуздық және iргелi сериялары үшін фотондардың минимум және максимум энергиясын, максимум және минимум толқын ұзындығын, минимум және максимум толқындық сандарын табу.
Бақылау сұрақтары
-
Сiлтiлiк элемент (Li, Na, K, Rb, Cs) атомының құрылымы қандай? Атомдық қалдық, тиiмдi заряд. -
Сiлтiлiк элемент атомын сутегi атомымен салыстырыңыз. Айырмашылығы, ұқсастығы неде? -
Энергетикалық деңгейлердiң «азғындалуы»деп ненi айтады? Мысал келтiру керек. -
Сiлтiлiк металл атомдары энергиясының орбиталық кванттық саны бойынша азғындалуының жойылуы қалай түсіндiрiледi? -
кванттық ақау шамасы неге тәуелдi? -
Кез-келген сiлтiлiк металл атомы үшін спектрлiк термдер жиынтығын белгiлей бiлу;
–негiзгi деңгейдi анықтай бiлу;
–энергетикалық деңгейлер схемасын сыза бiлу;
–байқалатын барлық сериялар үшін кванттық ауысуларды көрсете бiлу;
–қабылданған белгiлеу бойынша әрбiр сериядағы кванттық ауысуларды жаза бiлу.
-
Сұрыптау ережелерi, бұлардың физикалық мағынасы.
74
8. НАТРИЙ СПЕКТРЛІК СЫЗЫҚТАРЫНЫҢ НӘЗІК
ТҮЗІЛІСІН ЗЕРТТЕУ
8.1.Жұмыстың мақсаты мен мазмұны
Сiлтiлiк элементтер атомдарының энергетикалық деңгейлерi сызықтарының нәзiк түзілiсiмен танысу. Натрий атомының спектрлiк сызықтарының дублеттiк түзілiсiн тәжiрибелiк зерттеу. Дисперсиясы үлкен спектрографта (ДФС-8) натрий спектрiн алу. Спектрлiк сызықтардың нәзiк түзілiсi құраушыларының ара қашықтығы. Осы деректер бойынша натрий атомы Р-термдерiнiң жiктелу шамасын және осы жiктелу шамасының n бас кванттық сан мәндерiне тәуелдiлiгiн анықтау. а экрандау тұрақтысын анықтау.
8.2. Аппаратура
ДФС-8 спектрографы, УГЭ-4 генераторы.
8.3. Теориялық кiрiспе
Сiлтiлiк металл атомдарының спектрлiк сызықтарын ажыратқыштық қабілетi жоғары құралдармен зерттегенде осы сызықтардың әрқайсысы қос сызықтан (дублет) тұратындығы - күрделi екендiгi ашылды. Сызықтардың осылай құраушыларға жiктелуi спектрдiң
нәзiк түзілiсi деп аталады. Жақын орналасқан бiрнеше құраушылардан тұратын спектрлiк сызықтарды мультиплеттер деп атайды. Әр түрлі атомдардың мультиплеттегi құраушылар саны екiге (дублет), үшке (триплет), төртке (квартет) және т.т. тең болуы мүмкін; дара спектрлiк сызықтар да болады, бұлар синглеттер деп аталады.
Сiлтiлiк металл атомдарының спектрлiк сызықтарыныңәрқайсысы екiқұраушыдан тұрады және бұлардың аралары литийде өте жақын, ал атомдық массалары артқан сайын аралары алшақтай беретiндiгi тағайындалған. Мәселен, резонанстық сызықтың жiктелу шамасы (, нм) төмендегiдей болады.
| элемент | Z | , нм |
| Li | 3 | 0,015 |
| Na | 11 | 0,6 |
| K | 19 | 3,4 |
| Cs | 55 | 42,2 |
Спектрлiк сызықтардың жiктелуi, араларында кванттық ауысулар болатын энергия деңгейлерiнiң жiктелуiмен байланысты болуға тиiс. Басқаша айтқанда спектрлiк сызықтың нәзiк түзілiсi электронның энергия деңгейлерiнiң нәзiк түзілiсiмен байланысты болуға тиiс.
С
75
iлтiлiк металдар атомдарының энергетикалық спектрiн қарастырайық.
8.3.1.Сiлтiлiк металдар атомдарының энергетикалық спектрi
Сiлтiлiк металл атомы ядроның кулондықөрiсiндегi көп электрондар жүйесi болғандықтан мұның энергетикалық спектрiн есептеу қиын әрi күрделi болып табылады. Сондықтан мынадай әдiс қолданылады-есептеудi жеңiлдететiн ұйғарым жасалады: атомның iшкi қабатындағы электрондар ядроға жақын орналасқан (ядро және iшкi қабаттардағы электрондар атомдыққалдықтүзеп тұрады), ал атоммен әлсiз байланысқан сыртқы электрон, керiсiнше, ядродан жеткiлiктi үлкенқашықтықта болады деп ұйғарып, сiлтiлiк металл атомы сутегi тәрiздi жүйе ретiнде қарастырылады (сыртқы электрон-атомдық қалдық). Осылай қарастырғанда, сыртқы электронның атомның қалған электрондарымен әсерлесуi, атомдық қалдықтың сыртқы электронды кулондық тартылысына қабаттасатын болмашы ұйытқу ретiнде ескерiледi; ал осы жағдайдағы атом энергиясы үшін сутегi атомының энергия өрнегiне ұқсас өрнек алынады;
 (8.1)
(8.1)мұндағы n=(n-


