ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 24
Скачиваний: 5
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение высшего образования
«Тольяттинский государственный университет»
Тольяттинский государственный университет
| (наименование института полностью) |
| Институт инженерной и экологической безопасности |
| (Наименование учебного структурного подразделения) |
| 20.03.01 Техносферная безопасность |
| (код и наименование направления подготовки / специальности) |
| Противопожарные системы |
| (направленность (профиль) / специализация) |
Практическое задание №1
по учебному курсу «Химия»
(наименование учебного курса)
Вариант 14 (при наличии)
| Обучающегося | Позднякова Анастасия Сергеевна | |
| | (И.О. Фамилия) | |
| Группа | ТБбп-2006бс | |
| | | |
| Преподаватель |  Авдякова Ольга Сергеевна Авдякова Ольга Сергеевна | |
| | (И.О. Фамилия) | |
Тольятти 2022
Задача 1.
Определить молярную массу вещества, если 380 мл его паров при 97
0С и давлении 98,66 кПа имеют массу 1,9 г
Дано:
V=380 мл
T=970 C
P=98.66 кПа
M=1.9 г
Решение: выразим данные задачи в системе СИ:
Р=9.866*104 Па
V=3.8*104 м3
M=1.9*10-3 кг
Т= (273+97)К=3700К
Подставим данные в уравнения Клапейрона–Менделеева: РV=mRT/M и рассчитаем М:
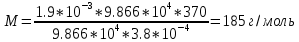
Ответ:185г./моль.
Задача 2
0,582 г меди растворено в азотной кислоте. Полученная соль разложена, в результате чего образовалось 0,7285 г оксида меди. Вычислить молярную массу эквивалента меди.
Решение:
Cu → Cu(NO3)2 → CuO
0,582 г меди эквивалентны 0,728 г оксида меди.
ЭCuO = M(CuO)/(число атомов элемента*валентность элемента) = 80/(1*2) = 40 г/моль
ЭCu = 0,582*40/0,728 = 32 г/моль
Ответ: 32 г/моль.
Задача 3
-
Элемент таблицы Менделеева 84: Ро polonium
Электронная формула атома полония в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p4
Полоний — радиоактивный химический элемент 16-й группы. Po (полоний) - элемент с прядковым номером 84 в периодической системе. Находится в VI периоде. Температура плавления: 254 ℃. Плотность: 9.2 г/см3. Количество валентных электронов в атоме полония - 6.
В ядре - 84 протона и 125 нейтронов, электронная оболочка – 84 электрона.
-
Элемент таблицы Менделеева 44: Ru ruthenium
Электронная формула атома рутения в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d7 5s1
Ru (рутений) – химический элемент 8-й группы.Ru (рутений) – элемент с порядковым номером 44 в периодической системе. Находится в V периоде. Температура плавления: 2310 ℃. Плотность: 12.45 г/см3.
В ядре - 44 протона и 57 нейтронов, а вокруг, электронная оболочка 44 электрона.
Задача 4
При полном сгорании этилена (с образованием жидкой воды) выделилось 6226 кДж тепла. Рассчитать объем вступившего в реакцию кислорода (н. у.)
Решение:
ΔН0х.р.=(2ΔƒH0CO2+2ΔƒH0H2O)-(ΔƒH0C2H4+3ΔƒH0O2)
ΔН0х.р.=[2(-393.5)+2(-285.8)]-52.3=-1322.9кДж.
Ответ: -1322.9кДж.
Задача 6
В газофазной системе SО2 + СО2 ↔ SО3 + СО при некоторой температуре константа равновесия равна 2,45.
Рассчитать равновесные концентрации всех компонентов, если исходные концентрации диоксидов углерода и серы равны и составляют 2 моль/л
Решение:
SО2(г) + СО2(г) ↔ SО3(г) + СО (г) Начальные концентрации SO2 и СО2 равны 2 моль/л, начальные концентрации SO3 и СО равны 0 моль/л. Пусть реагирует х моль/л SO2, тогда реагирует х моль/л CO2, SO3 и СО. Равновесные концентрации SO2 и СО2 равны (2-х) моль/л, равновесные концентрации SO3 и СО равны х моль/л. Запишем выражение для константы равновесия данного процесса и подставим в это выражение равновесные концентрации: К = ([SO3][CO])/([SO2][CO2]) = (х/(2-x))^2 = 2,45, отсюда х/(2-х) = 1,57. Находим х = 1,22.
Тогда равновесные концентрации SO2 и СО2 равны (2-1,22) = 0,78 моль/л, равновесные концентрации SO3 и СО равны 1,22 моль/л.
Ответ: 1.22 моль/л.
Задача 7
Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Вычислить процентную и моляльную концентрации оставшегося раствора
Дано:
m1(р-ра)= 700г
ω1(H2SO4)=60%
mвыпар=(H2O)=200г
ω2 =?
Решение:
m(H2SO4)=ω1(H2SO4)⋅m1(р-ра)100=60⋅700100=420г
m2(р-ра)=m1(р-ра)−mвыпар.(H2O)=700−200=500г
ω2(H2SO4)=100⋅m(H2SO4)m2(р-ра)=100⋅420500=84%
Ответ: ω2(H2SO4)=84%
