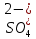ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 10
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Ижевский государственный технический университет имени М.Т.Калашникова»
Кафедра "Химия и химическая технология"
Лабораторная работа №1
На тему: «Химические источники тока»
Выполнил:
Студент группы Б22-831-1зу Алабужев И.Ф.
Руководитель:
Кандидат технических наук, Доцент кафедры Семакина Н.В.
Ижевск 2023г
Цель работы:
- Познакомится с устройством и принципом работы гальванического элемента.
- Научиться определять направление протекания окислительно-восстановительных процессов по окислительно-восстановительным потенциалам реагирующих веществ.
I. Теоретическая часть.
1. Химические источники тока (абр. ХИТ) — это источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
2. При контакте поверхности металлического электрода с электролитом вследствие второго закона термодинамики происходит переход ионов в раствор. В водных растворах электролитов за счет процесса гидратации с поверхности металла в раствор будут переходить катионы металла. Процесс превращения нейтральных атомов металла в заряженные катионы по химическим представлениям является процессом окисления с потерей определенного количества электронов Хе . Электроны металла в раствор не переходят, так как не гидратируются (сродство к электрону у молекулы воды отрицательно). Атом металла имеет па поверхности электрода нулевую степень окисления Ме°, а в растворе — вследствие потери 1е
электронов — положительную Ме2+.
В результате поверхность металла приобретает избыток электронов и, соответственно, отрицательный электрический заряд. Отрицательное поле возникшего заряда притягивает из раствора уже гидратированные катионы вместе с молекулами воды. На межфазной границе «металл — электролит» устанавливается равновесие окислительно-восстановительной реакции:
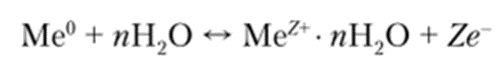
Со стороны раствора возникает слой гидратированных катионов Ме+Н20, который взаимодействует с отрицательно заряженной поверхностью металла электрода. В ходе этого взаимодействия некоторые катионы возвращаются на поверхность металла и снова становятся нейтральными атомами:
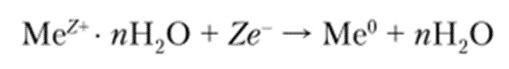
Кроме явлений гидратации и электростатического взаимодействия ионов, на поверхности электрода происходит адсорбция как молекул воды, так и присутствующих в растворе ионов. Это создает весьма сложную конфигурацию заряженных частиц, которую называют обменный двойной электрический слой (рис.1). Скачок электрического потенциала на межфазной границе «электрод — электролит», соответствующий электрохимическому равновесию, называется равновесным электродным потенциалом. Важнейшими элементами электрохимической системы являются электроды, на поверхности которых и протекает окислительно-восстановительная реакция.
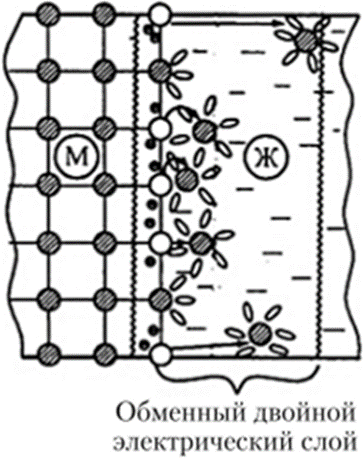
Рис. 1. Схема возникновения обменного двойного электрического слоя и электродного потенциала на границе «металл — раствор электролита»:
 — катионы металла, расположенные в узлах кристаллической решетки;
— катионы металла, расположенные в узлах кристаллической решетки;
 — гидратированные катионы металла, перешедшие в раствор;
— гидратированные катионы металла, перешедшие в раствор;
• — избыточные электроны, оставшиеся в металле после ухода катионов
3. Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. Было выведено немецким физико-химиком Вальтером Нернстом.
{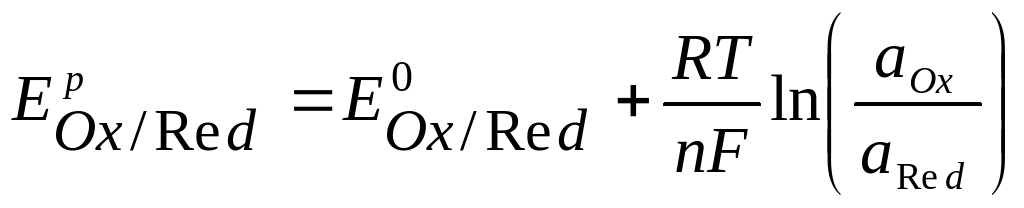 \displaystyle E=E^{\circ }+{\frac {0,0591
\displaystyle E=E^{\circ }+{\frac {0,0591
{\rm {V}}}{n}}\lg \prod a_{i}^{\nu _{i}}}
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Ижевский государственный технический университет имени М.Т.Калашникова»
Кафедра "Химия и химическая технология"
Лабораторная работа №1
На тему: «Химические источники тока»
Выполнил:
Студент группы Б22-831-1зу Алабужев И.Ф.
Руководитель:
Кандидат технических наук, Доцент кафедры Семакина Н.В.
Ижевск 2023г
Цель работы:
- Познакомится с устройством и принципом работы гальванического элемента.
- Научиться определять направление протекания окислительно-восстановительных процессов по окислительно-восстановительным потенциалам реагирующих веществ.
I. Теоретическая часть.
1. Химические источники тока (абр. ХИТ) — это источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
2. При контакте поверхности металлического электрода с электролитом вследствие второго закона термодинамики происходит переход ионов в раствор. В водных растворах электролитов за счет процесса гидратации с поверхности металла в раствор будут переходить катионы металла. Процесс превращения нейтральных атомов металла в заряженные катионы по химическим представлениям является процессом окисления с потерей определенного количества электронов Хе . Электроны металла в раствор не переходят, так как не гидратируются (сродство к электрону у молекулы воды отрицательно). Атом металла имеет па поверхности электрода нулевую степень окисления Ме°, а в растворе — вследствие потери 1е

где –
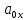 – активность окисленной формы.
– активность окисленной формы.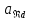 – активность восстановленной формы.
– активность восстановленной формы. 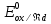 - стандартный электродный потенциал
- стандартный электродный потенциалR – универсальная газовая постоянная, 8,31Дж/моль.К;
n – число электронов, принимающих участие в реакции (равно числу моль эквивалентов в моль вещества);
F – число Фарадея, 96500 Кл/моль;
T – температура, К.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при Т=298 К, получим:
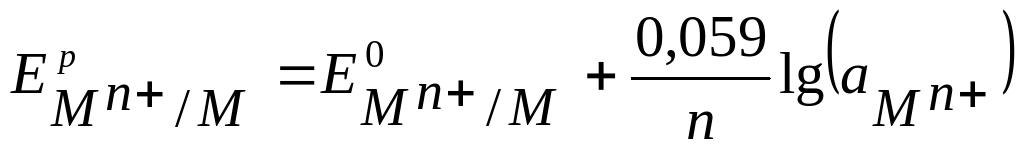
где
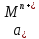 - молярная концентрация ионов металла в растворе электролита
- молярная концентрация ионов металла в растворе электролита4. Анод – это электрод с меньшим значением электродного потенциала.
Катод – электрод с большим значением электродного потенциала.
5. ЭДС – максимальная разность потенциалов на концах равновесной электрохимической цепи.
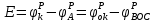
где
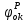 – электродный потенциал пары, выступающий в роли окислителя.
– электродный потенциал пары, выступающий в роли окислителя.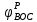 - электродный потенциал пары, выступающий в роли востановителя.
- электродный потенциал пары, выступающий в роли востановителя.II. Экспериментальная часть.
Опыт 1. Составление медно-цинкового гальванического элемента
Выполнение опыта: Собрали гальванический элемент, представленный на рисунке (рис.2). Для этого первый стакан заполнили 1М раствором CuSO4, а второй – 1М раствором ZnSO4. Растворы соединили электролитическим мостиком из полоски фильтрованной бумаги, смоченной насыщенным раствором
KCl. Опустили в раствор ZnSO4 цинковую пластину, а в раствор CuSO4 – медную. Пластинки цинка и меди с помощью электрических проводов происоединили к гальвонометру.
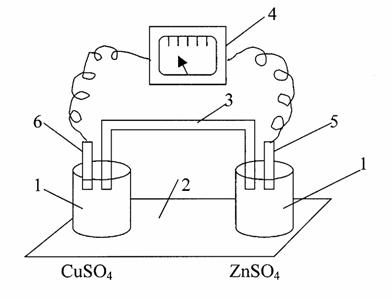
Рис.2. Гальванический элемент медно-цинковый:
1-стаканчики; 2-подставка; 3-электролитный мостик;
4- рН-метр (иономер); 5-цинковый электрод; 6-медный электрод
Наблюдения: В процессе опыта наблюдали отклонение стрелки гальвонометра, указывающее на воникновение электрического тока.
Оформление результатов опыта. Фактический замер ЭДС – 0.9В
- По уравнению Нернста вычисляем равновесные электродные потенциалы цинка и меди
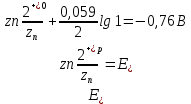
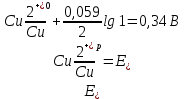
- Определяем Анод и Катод
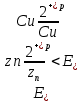
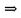 Zn – Анод, Cu – Катод
Zn – Анод, Cu – Катод- Расчет ЭДС
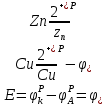 = 0,34 - (-0,76) = 1,1В
= 0,34 - (-0,76) = 1,1ВФактически замеренное ЭДС отличается о расчетного. Различие значений обуславливается погрешностью измерительного прибора и отличием условий внешней среды от стандартных значений.
- Электродные процессы или окислительно-восстановительных реакций
A(-):
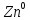 -
- 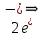
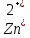 (окисление)
(окисление)K(+):
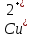 +
+ 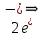
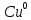 (восстановление)
(восстановление)- Уравнение токообразующей реакции
Zn +
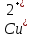
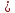
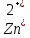 + Cu
+ Cu Zn +
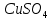

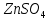 + Cu
+ Cu- Схема медно-цинкового гальванического элемента
(-) Zn ǀ ZnS
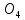 ǀǀ CuS
ǀǀ CuS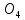 ǀ Cu(+) , или
ǀ Cu(+) , или(
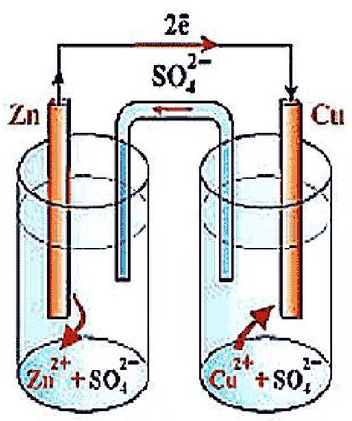 -) Zn ǀ
-) Zn ǀ  ǀǀ
ǀǀ  ǀ Cu (+)
ǀ Cu (+)

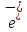


 (-)А Zn ǀ Zn
(-)А Zn ǀ Zn 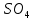 ǀǀ
ǀǀ  ǀ CuK(+)
ǀ CuK(+)