Файл: Термодинамика 8 билет Химиялы тепетедік термодинамикасы бойынша біліміізді талылап, тсіндірііз.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 9
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Термодинамика
8 билет
-
Химиялық тепе-теңдік термодинамикасы бойынша біліміңізді талқылап, түсіндіріңіз.






Химиялық тепе-теңдік — бір немесе бірнеше қарама-қарсы жүретін қайтымды реакциялар жылдамдықтарының теңескен күйі.Қайтымды реакция аяғына дейін жүрмейді, ол басталғанда тура жүретін реакцияның жылдамдығы (v1) жоғары, кері реакцияжылдамдығы (v2) баяу болады. Тура реакция жүрген сайын реакцияға алынған заттың концентрациясы азайып, v1 — жылдамдығы кемиді, керісінше, тіке реакциядан пайда болған өнімнің концентрациясы артып, v2 күшейеді. Біртіндеп екі реакция жылдамдығы теңеседі: v1=v2. Осындай жағдайды химиялық тепе-теңдік деп атайды. Тепе-теңдік орнағанмен қарама-қарсы бағытталған екі реакция да тоқтамай жүре береді. Егер сыртқы жағдай (қысым, концентрация, температура) өзгермесе реакция жылдамдықтары тең болып, химиялық тепе-теңдік орнаған қалпында қала береді, сондықтан оны жылжымалы немесе [динамикалық] тепе-теңдік деп те атайды. Реакцияласушы жүйенің бір тепе-теңдік күйден басқа басқа тепе-теңдік күйге ауысуынхимиялық тепе-теңдіктің ығысуы дейді. Химиялық тепе-теңдік орнаған кездегі реакцияға қатысқан әр заттың концентрациясы тепе-теңдік концентрациясы деп аталады. Химиялық тепе-теңдікті сан жағынан сипаттайтын көрсеткіш тепе-теңдік константасы (тұрақтысы) (К) деп аталады: aA+bB=pP+qQ, мұндағы бас әріптер — заттардың формулалары, кіші әріптер — реакциядағы молекула сандарын көрсететін коэффициенттер. Тепе-теңдік константасы тура және кері реакциялардың жылдамдық константаларының (k1,k2) қатынасы деп те аталады: K=k1/k2. К — белгілі температурада тура реакция өнімдері мен реакциясы алынған заттардың мольдік көбейтінділерінің қатынасын көрсететін тұрақты шама. Тепе-теңдік константасының теңдеуі реакцияға қатысқан заттардың тепе-теңдік концентрацияларының бір-біріне тәуелділігін көрсетеді. Химиялық тепе-теңдікті зерттеудің теориялық және практикалық маңызы бар.
Ле Шателье-Браун принципі, Ле Шателье — Браун принципі, тепе-теңдіктің ығысу принципі — жүйені термодинамикалық тепе-теңдік күйден ауытқытатын сыртқы әсердің салдарынан сол жүйедегі тепе-теңдік осы әсерді әлсірететін (немесе оған қарсы әсер ететін) реакция бағытына қарай ығысатындығын тұжырымдайтын принцип. Жүйедегі тепе-теңдіктің ығысуына реагенттер мен өнімдердің концентрацияларының, қысымның (газдар үшін) және температураның өзгеруі әсер етеді. Мысалы, аммиактыHӘ=–46кДж/моль.Dсинтездеу реакциясы: N2+3H22NH3,
Тепе-теңдік күйге келген жүйеде тура және кері реакциялардың жылдамдықтары бірдей болады. Жүйедегі азот немесе сутектіңконцентрациясын арттырғанда Ле Шателье принципі бойынша тепе-теңдік олардың концентрациясын кемітетін, яғни аммиак түзілетін бағытқа қарай ығысады. Керісінше, жүйедегі аммиак концентрациясын арттырғанда тепе-теңдік аммиактың концентрациясын азайтатын, яғни сутек пен азот түзілетін реакция бағытына қарай ығысады. Тура реакция жылу бөле жүретін болғандықтан жүйенің температурасын жоғарылатқанда тепе-теңдік Ле Шателье принципі бойынша сол әсерді бәсеңдететін, яғни жылу сіңіре жүретін реакция бағытына, яғни сутек пен азоттың түзілу реакциясы бағытына қарай ығысады. Керісінше жүйенің температурасын төмендеткенде тепе-теңдік жылу бөле жүретін реакция бағытына қарай ығысады.
Қысымның тепе-теңдікке әсерін болжау үшін реакция теңдеуінің сол және оң жақтарындағы молекулалар сандарын салыстыру керек. Қысымды ұлғайтқанда Ле Шателье принципі бойынша тепе-теңдік молекулалар саны азаятын, яғни аммиак түзілу реакциясы бағытына қарай ығысады. Керісінше қысымды кеміткенде тепе-теңдік молекулалар саны көбейетін жаққа ығысады. Егер қайтымды реакция теңдеуінің оң және сол жақтарындағы молекулалар саны бірдей болса, онда қысымның өзгеруі тепе-теңдіктің ығысуына әсер етпейді. Ле Шателье принциін 1885 ж. А. Ле Шателье (1850 — 1936) тұжырымдап, ал теорилық тұрғыдан 1887 ж.К.Ф. Браун (1850 — 1918) негіздеген
2. Химиялық реакциялардың изотерма теңдеулеріне талдау жасаңыз.

Термодинамикалық жүйеде өздігінен өтетін процесстердің жүруі жүйедегі бос энергияның азаюымен (dG < 0, dF < 0) қоса жүреді. Соған орай, ерте ме, кеше па (термодинамикада «уақыт» түсінігі жоқ екенін еске аламыз) жүйе бос энергия минимумына жетеді. Кейбір функциялардың Y = f(x) минимум шарттары болып бірінші туындының нөлге теңдігі және екінші туындының оң белгісі dY = 0; d
2Y > 0 саналады. Сондықтан, жабық жүйедегі термодинамикалық тепе-теңдіктің шарты болып сәйкес термодинамикалық потенциалдың минимал мәні саналады:
Изобарлы-изотермиялық (P = const, T = const):
ΔG = 0 dG = 0, d2G > 0
Изохорлы-изотермиялық (V = const, T = const):
ΔF = 0 dF = 0, d2F > 0
Изотерма (грекше изо... және therme – жылу) – изотермалық процесті кескіндейтін термодинамикалық күй диаграммасындағы сызық. Идеал газ изотермасының теңдеуі:
{\displaystyle pV=const}
 , мұндағы {\displaystyle p}
, мұндағы {\displaystyle p} – газ қысымы, {\displaystyle V}
– газ қысымы, {\displaystyle V} – газ көлемі.
– газ көлемі.{\displaystyle p,V}
 координаттарында изотерманың графигі – гипербола. Реал газ үшін изотерманың теңдеуі күрделі болып келеді. Ол теңдеу қысым аз немесе температура жоғары болғанда ғана идеал газ изотермасының теңдеуіне ауысады.[1]
координаттарында изотерманың графигі – гипербола. Реал газ үшін изотерманың теңдеуі күрделі болып келеді. Ол теңдеу қысым аз немесе температура жоғары болғанда ғана идеал газ изотермасының теңдеуіне ауысады.[1]ИЗОТЕРМА (грекше «изос – теңдей» + «терма – жылу») – күйлердің термодинамикалық диаграммасында изотермиялық үрдісті өрнектейтін сызықтар. Идеал газдың изотермиялық теңдеуі: pV-const, мұндағы p – қысым, V – газ көлемі. Сонымен, p, V координаттарында р, V изотерма гипербола тәрізді болады. Нақты газ үшін изотерма теңдеуі едәуір күрделі сипатты және тек төменгі қысым немесе жоғары температура кезінде ғана изотерма теңдеуіне ауысады. р, V коорданаттарында изотерма жүрісі әрқашан адиабатадан сәл ғана тіктеу болады.
ИЗОТЕРМАЛЫҚ ҮРДІС – физикалық жүйеде тұрақты температура кезінде өтетін үрдіс; күйлердің термодинамикалық диаграммасында изотермамен кескінделеді. Жүйенің изотермалық үрдісін жүзеге асыру үшін термостатқа (тұрақты температура ұстап тұратын құрылғыға) орналастырылады, мұның жылу өткізгіштігі жоғары, жүйенің температурасы іс жүзінде термостаттың температурасынан айырмашылығы болмайды. Изотермалық үрдісті өзгеше де: жылу көздерін немесе жылу ағынын қолдану арқылы жүзеге асыруға болады. Изотермалық үрдістің мысалына тұрақты температурадағы сұйықтың қайнауы немесе қатты дененің балқуы жатады. Идеал газда изотермалық үрдісте қысымның көлемге көбейтіндісі тұрақты болады (Бойль – Мариот заңы), Жүйедегі изотермалық үрдіс кезінде, жалпылама айтқанда, белгілі бір мөлшерде жылу беріледі (немесе жүйе жылу береді) және
сыртқы жұмыс жүзеге асырылады. Идеал газдар үшін осы жұмыс Nk Тln (V2/V1), мұндағы N – газ бөлшекте- рінің саны, Т – абсолюттік температура, V1 және V2 – үрдістің (процестің) бастапқы және соңғы кездеріндегі көлемдері. Егер тек фазалық ауысу жүзеге асырыл- майтын болса, қатты денелерде және көптеген сұйықтарда изотермалық үрдіс дене көлемін сәл ғана өзгертеді.
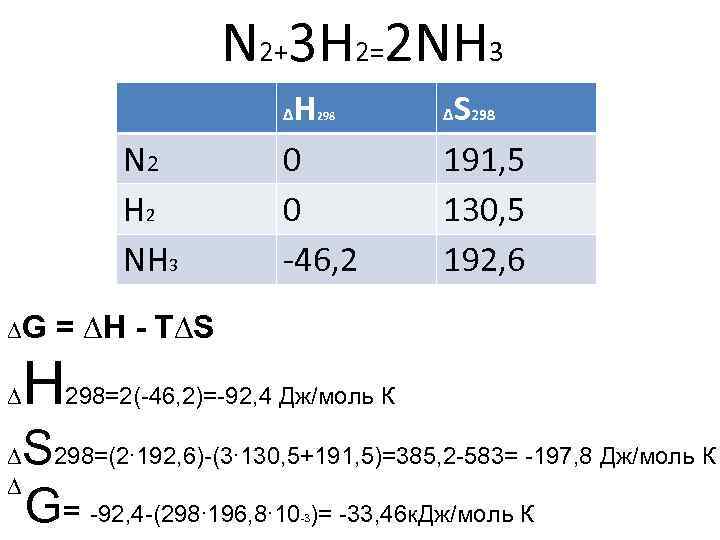
3. Стандартты түзілу энтальпиясы және абсолютті энтропия мәндері бойынша 298 К температурада келесі химиялық реакцияның стандартты изобаралық потенциал өзгерісін есептеңіз: N2(г) + 3H2(г) ↔ 2NH3(г).
9 билет
-
Тепе-теңдіктің ығысуына концентрацияның әсері бойынша оқыған материалдарыңызды еске түсіріп, тұжырымдаңыз.


Концентрацияның әсері. Реакцияға түсетін заттардың концентрацияларын
арттырса, тепе-теңдік сол концентрациялардың азаятын жағына, яғни реакция
өнімі түзілетін жаққа ығысады (тура реакция жүреді). Керісінше, азайтса, реакция
нәтижесінде түзілген өнімнің айрылуы жүреді, кері реакция жүреді.
N2(г) + 3H2(г) ↔ 2NH3 (г) + Q
Тура реакция жылу бөліп шығара жүретін (экзотермиялық), ал кері реакция жылу сіңіре
жүретін (эндотермиялық) екені көрсетілген. Сондықтан температураны жоғарылатса,
1. Ле-Шателье принципі бойынша, химиялық тепе-теңдік бұл өзгеріске қарсы
әсер ететін бағытта, яғни температураны төмендететін эндотермиялық
реакцияның бағытына қарай ығысады. Егер жүйенің температурасын
төмендетсе, онда химиялық тепе-теңдік оны төмендететін, яғни жылу шығара
жүретін NH3-тің түзілу бағытына қарай ығысады.
2. Ле-Шателье принципі бойынша, жүйенің қысымын жоғарылатса, химиялық
тепе-теңдік осы қысымды азайтатын, яғни газдардың көлемдері немесе моль
сандары аз заттар түзілетін реакцияның бағытына қарай ығысады, яғни NH3
түзілу бағытына қарай ығысады.
3. Ле-Шателье принципі бойынша бір заттың концентрациясының кебеюі
химиялық тепе-теңдікті сол заттың концентрациясын азайтатын реакцияның
бағытына қарай ығысады.
4. Ле-Шателье принципіне сәйкес аммиакты алу реакцияны тура бағытта, яғни
қайтымсыз етіп жүргізу үшін, оны жоғары қысымда, төмен температурада және
N2 мен H2 жеткілікті мөлшерде, ал NH3-ті бөліп алу арқылы азайта отырып,
жүргізу керек.
5.
Ле Шателье принципі. Жағдайды өзгертпесе тепе-теңдікке келген жүйенің
күйі сақталады. Сыртқы жағдайдың ( реагенттер концентрацияларының,
қысымның , температураның )өзгеруінің тепе-теңдікке әсерін Ле Шателье
принципін (жылжымалы тепе-теңдік принципін) қолдану арқылы
анықтауға болады: Химиялық тепе-теңдік күйге келіп тұрған жүйенің
жағдайының біреуін өзгерту, тепе-теңдікті сол өзгертуге қарсы
әрекет туғызатын реакция бағытына қарай ығыстырады.
Температура әсері. Температура көтерілгенде тепе-теңдік эндотермиялық
реакция бағытына қарай, ал температура төмендегенде экзотермиялық
реакция бағытына қарай ығысады(Вант-Гофф заңы - Ле Шателье принципінің
жеке бір түрі
2СО + О2 2СО2 , Н 0 ;
N2O4 2NO2 ,
H 0 .
Қысымның әсері. Тепе-теңдікте тұрған жүйенің сыртқы қысымын көбейткенде
тепе-теңдік жүйедегі молекулалардың жалпы саны азаятын реакцияның бағытына
қарай , яғни жүйенің ішкі қысымы кемитін жаққа қарай ығысады. Керісінше,
сыртқы қысымды кеміткенде тепе-теңдік жүйедегі молекулалардың жалпы саны
көбейетін бағытына қарай , яғни ішкі қысымның өсуі жағына қарай ығысады.
Мысалы,
N2 + 3H2 2NH3
тепе-теңдіктің сол жағында 4 молекула, оң жағында 2 молекула , сонда сыртқы
қысым арттқанда тепе-теңдік оң жаққа , аммиак түзілетін жаққа ығысады.
Тепе-теңдіктің екі жағындағы молекулалар саны бірдей болса,
N2 + O2 2NO
онда қысымды өзгерту тепе-теңдікке әсер етпейді.
-
Әр түрлі процестердің және химиялық реакциялардың энтропиясының өзгерісін есептеп, қорытындылаңыз.




