Файл: Молекулярная адсорбция из растворов. Факторы, влияющие на молекулярную адсорбцию вещества из раствора от равновесной концентрации адсорбтива, от природы растворителя, от природы адсорбента, от природы адсорбтива, от температуры.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.03.2024
Просмотров: 8
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Тема 6 , рубежный контроль
-
Молекулярная адсорбция из растворов. Факторы, влияющие на молекулярную адсорбцию вещества из раствора: от равновесной концентрации адсорбтива, от природы растворителя, от природы адсорбента, от природы адсорбтива, от температуры.
Молекулярная адсорбция – адсорбция из растворов неэлектролитов (веществ, которые на ионы не распадаются и электрический ток не проводят) или слабых электролитов (веществ, которые проводит электрический ток вследствие диссоциации на ионы). В этих случаях растворенные вещества адсорбируются на поверхности твердого тела в виде молекул. Молекулярную адсорбцию рассчитывают по следующей формуле:

Особенностью молекулярной адсорбции является то, что вместе с растворенным веществом адсорбируются молекулы растворителя. Факторы, влияющие на молекулярную адсорбцию:
равновесная концентрация растворенного вещества;
природа растворителя;
природа адсорбента;
природа растворенного вещества;
температура адсорбции.
-
Влияние равновесной концентрации адсорбтива (сS)на молекулярную адсорбцию описывается изотермами адсорбции, которые можно свести к следующим видам: изотерма Ленгмюра, которая отвечает мономолекулярной адсорбции и описывается уравнением Ленгмюра:


изотерма адсорбции, которая сопровождается абсорбцией;
изотерма адсорбции для случаев, когда адсорбент достаточно хорошо адсорбирует растворитель;
изотерма отрицательной адсорбции, когда концентрация молекул растворенного вещества в адсорбционном слое меньше, чем в объеме раствора.
-
Влияние природы растворителя на молекулярную адсорбцию Чем хуже адсорбируется растворитель, тем лучше будет адсорбироваться растворенное вещество. А растворитель адсорбируется тем хуже, чем больше его поверхностное натяжение () на границе Т-Ж. Отсюда следуют две закономерности:
адсорбция на твердом адсорбенте идет лучше из водных растворов и хуже из органических растворов;
правило Шилова: чем лучше растворитель растворяет вещество, тем хуже вещество адсорбируется из раствора.
-
Влияние природы адсорбента на молекулярную адсорбцию
Пора– это минимальное пространство между частицами вещества. Пористость– отношение объема пор к общему объему материала. Из свойств адсорбента на адсорбцию влияют его полярность и пористость. Экспериментальные данные позволили сформулировать правило: неполярные твердые тела лучше адсорбируют неполярные адсорбтивы. Степень влияния пористости определяется соотношением размеров пор адсорбента и молекул растворенного вещества. Если молекулы растворенного вещества малы и легко проникают в поры твердого тела, то адсорбция идет лучше. Крупные молекулы не могут попасть в узкие поры адсорбента, и адсорбция уменьшается.
-
Влияние природы адсорбтива на молекулярную адсорбцию ПАВ в силу своей дифильности растворяются как в полярных, так и в неполярных растворителях. В зависимости от вида растворителя должен выбираться подходящий адсорбент. Так для адсорбции ПАВ из водных растворов следует использовать гидрофобные (неполярные) твердые тела, например, уголь. При адсорбции молекулы ПАВ строго ориентированы: углеводородный радикал взаимодействует с поверхностью угля, а полярная часть — с водой.
Можно отметить следующие правила:
1. С увеличением молярной массы растворенного вещества его адсорбционная способность возрастает.
2. Ароматические соединения адсорбируются лучше, чем алифатические.
3. Непредельные органические соединения адсорбируются лучше, чем предельные.
4. При адсорбции предельных органических кислот и спиртов качественно соблюдается эмпирическое правило Дюкло-Траубе: Адсорбционная способность увеличивается в 3— 3,5 раза при удлинении углеводородной цепи на одно звено (-СН2-).
Следует заметить, что указанные правила не выполняются для адсорбции на мелкопористых адсорбентах.
5) Влияние температуры и времени на адсорбцию Адсорбция из растворов идет медленнее адсорбции газов, так как диффузия в жидкостях протекает значительно медленнее. Она может быть ускорена перемешиванием. Особенно медленно происходит адсорбция больших молекул на мелкопористых адсорбентах, так как в этих случаях равновесие устанавливается медленно или вовсе не наступает. Повышение температуры приводит к уменьшению адсорбции.
-
Эмульгаторы: природа, механизм действия, примеры. Типы эмульсий: чем они определяются, как их определяют? Схемы. Обращение фаз эмульсий. Роль эмульсий в биологии и медицине.
Эмульгаторы - поверхностно-активные вещества, способные понижать поверхностную энергию на границе раздела фаз с образованием стабильных дисперсных систем, состоящих из внутренней дисперсной фазы, а также внешней непрерывной дисперсионной среды.
Действие эмульгаторов основано на способности поверхностно-активных веществ (ПАВ) снижать энергию, необходимую для создания свободной поверхности раздела фаз.
Концентрируясь на поверхность раздела смешивающихся фаз, ПАВ снижают межфазное поверхностное натяжение и обеспечивают длительную стабильность композиции.
В зависимости от природы ПАВ они ускоряют образование и стабилизируют тип эмульсии, в дисперсионной среде в которой они лучше растворимы.
Гидрофильные и гидрофобные эмульгаторы.
В наиболее важном с практической точки зрения случае эмульгаторы представляют собой дифильные вещества, молекулы которых имеют в своём составе, как полярную (гидрофильную) группу, так и неполярную (гидрофобную) часть.
В качестве примера дифильных веществ можно привести лецитин:

Именно благодаря наличию такой двойственной структуры становится возможной стабилизация, поскольку дифильные вещества имеют возможность одновременно взаимодействовать, как с водой и водорастворимыми веществами, так и с маслами или веществами жирной природы.
Эмульгаторы, молекулы которых имеют относительно длинную гидрофобную часть, обладают преимущественно гидрофобными свойствами. Такие эмульгаторы называют гидрофобными.
И, наоборот, эмульгаторы с относительно короткой гидрофобной частью, имеют большее сродство с водой и их, поэтому называют гидрофильными.
Гидрофильные эмульгаторы необходимы для стабилизации эмульсий типа «масло в воде». При добавлении гидрофильного эмульгатора в такую эмульсию вокруг капельки масла образуется сплошной слой эмульгатора, сообщающий ей некоторую гидрофильность и повышающий её устойчивость (Рис. а).
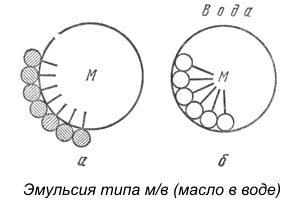
Добавление в такую же смесь гидрофобного эмульгатора, большая часть молекулы которого погружается в капельку масла, не обеспечивает устойчивости эмульсии, поскольку часть поверхности капельки остаётся «открытой» и легко может происходить слияние с другими капельками.
Биологическое значение эмульсий
Пищевые продукты
Примером эмульсий является молоко, которое представляет собой взвешенные в воде частички жира, эмульгированные белком (казеиногеном).
При стоянии молока образуется слой концентрированной эмульсии (сливки).
Сбивание сливок приводит к разрушению белковой оболочки, жир коалесцирует в крупные комочки сливочного масла, которое тоже представляет собой эмульсию, но уже типа «вода в масле».
Аналогичными этому типу эмульсиями являются:
-
Маргарин, -
Майонез, -
Мороженное и пр.
Маргарин – эмульсия из мелкораздробленных гидрогенезированных растительных жиров.
Эмульсии в физиолгии человека
Эмульсии нередко встречаются в организме человека:
1. Жиры в крови и лимфе находятся в эмульгированном состоянии (эмульгатор – белки крови).
2. При пищеварении в кишечнике также образуется жировая эмульсия, но здесь стабилизатором служат соли желчных и жирных кислот. Опыты показали, что растворы солей желчных кислот могут обладать поверхностным натяжением менее 1 эрг/см2, т.е. настолько низким, что может идти самопроизвольное раздробление жира (без его механического измельчения). Таким образом, желчь имеет важное значение для переваривания и всасывания жиров в жилудочно-кишечном тракте.
3. Эритроциты в крови можно по ряду свойств рассматривать так же, как частички гидрофобной эмульсии.
На их поверхности отсорбированы молекулы белков, аминокислот и ионы электролитов. Все они сообщают эритроцитам определённый отрицательный заряд, а противоионы создают некоторый диффузный слой.
При паталогических процессах в организме
, когда в крови увеличивается содержание некоторых видов белков (либо особого глюкопротеида, относящегося к альфа-глобулинам, либо при инфекционных заболеваниях гамма-глобулинов) происходит процесс, очень напоминающий ионообменную адсорбцию: место ионов электролитов на поверхности эритроцитов занимают белки, заряд которых ниже, чем у суммы замещённых ими ионов.
В результате заряд эритроцитов понижается, они быстрее объединяются и оседают (ускоряется реакция оседания эритроцитов – РОЭ).
Этот процесс зависит ещё от ряда факторов: содержания других белковых фракция и мукополисахаридов, концентрации эритроцитов в кровии, от наличия в крови микробов, наконец, расположения сосуда, в котором наблюдается РОЭ (в частности, скорость её ниже в наклонно расположенном капиляре).
Оседание эритроцитов происходит сходно с процессом седиментации гидрофобного коллоида.
-
ИЭТ белка 5,1. Каков заряд молекул белка, растворенного в буферном растворе, приготовленном из 488 мл 0,2 М раствора КН2РО4 и 512 мл 0,2 М раствора Na2НР04?



