Файл: Лабораторная работа 3 Теплоемкость идеального газа по дисциплине (учебному курсу) Физика 1.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.04.2024
Просмотров: 26
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
М
 ИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИфедеральное государственное бюджетное образовательное учреждение
высшего образования
«Тольяттинский государственный университет»
АРХИТЕКТУРНО-СТРОИТЕЛЬНЫЙ ИНСТИТУТ
(наименование института полностью)
Центр архитектурных, конструктивных решений и организации строительства
(наименование кафедры/департамента/центра полностью)
08.03.01 Строительство
(код и наименование направления подготовки, специальности)
Промышленное и гражданское строительство
(направленность (профиль) / специализация)
ЛАБОРАТОРНАЯ РАБОТА №3
«Теплоемкость идеального газа»
по дисциплине (учебному курсу) «Физика 1»
(наименование дисциплины (учебного курса)
Вариант 4 (при наличии)
| Студент | Материков Н.Д. (И.О. Фамилия) | |
| Группа | СТРбд-1903в | |
| Преподаватель | Панферов А.А. (И.О. Фамилия) | |
Тольятти 2023
Цель работы:
Знакомство с теплоемкостью идеального газа в изохорическом и изобарическом процессах.
Экспериментальное подтверждение закономерностей изопроцессов.
Экспериментальное определение количества степеней свободы и структуры молекул газа в данной модели.
Результаты измерений и расчетов:
1. Одноатомный газ: V0=70, p0=200, ν=1,8
Таблица 2
| Т, К | 300* | 400 | 500 | 600 | 700 | 800 |
| QV,кДж | 2,24 | 4,49 | 6,73 | 8,97 | 11,22 | 13,46 |
| Qр,кДж | 2,08 | 4,16 | 6,23 | 8,31 | 10,39 | 12,47 |
*Значения абсолютной температуры может не совпадать с рекомендуемым, но должно быть близким по значению и одинаковым для Qp и QV в столбце.
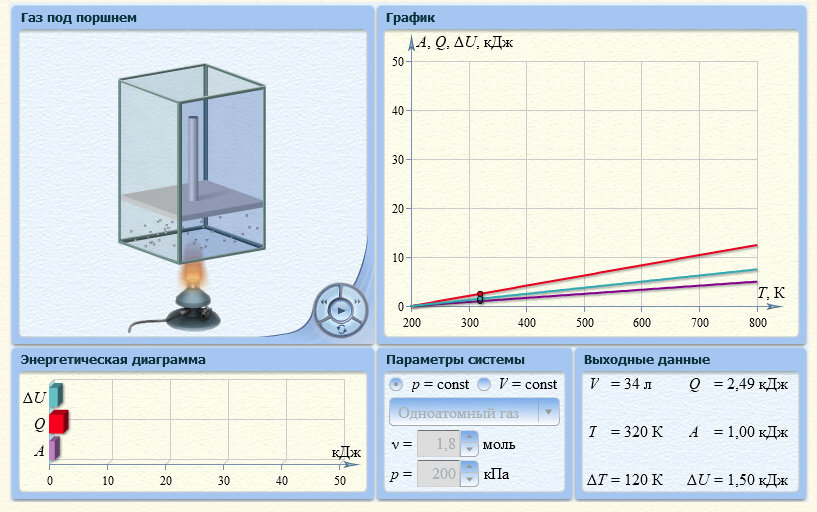
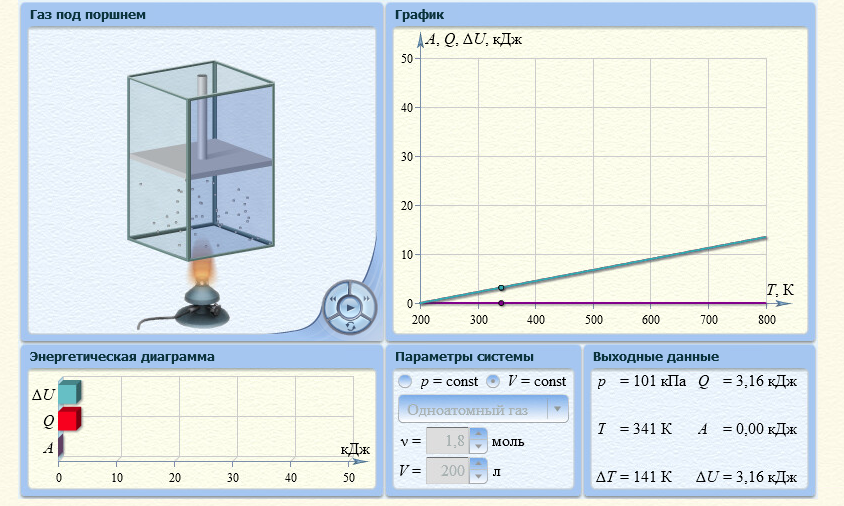
Графики зависимостей QV=f(T) и Qp=f(T) для одноатомного газа (на одном чертеже) по табл.2.
(Все графики могут быть выполнены с использованием спецсредств MSOffice или др. приложений Определение Cp теплоемкости и cp молярной теплоемкости газа при постоянном давлении:
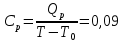
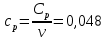
Определение CV теплоемкости и cV молярной теплоемкости газа при постоянном объеме:
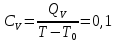
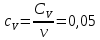
Определение γ постоянной адиабаты:
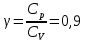
Определение iчисла степеней свободы молекул газов:
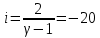
2. Двухатомный газ: V0=70, p0=200, ν=1,8
Таблица 3
| Т, К | 300 | 400 | 500 | 600 | 700 | 800 |
| QV,кДж | 3,74 | 7,48 | 11,22 | 14,96 | 18,70 | 22,44 |
| Qр,кДж | 5,24 | 10,47 | 15,71 | 20,94 | 26,18 | 31,41 |
Графики зависимостей QV=f(T) и Qp=f(T) для двухатомного газа (на одном чертеже) по табл.3:
Определение Cp теплоемкости и cp молярной теплоемкости двухатомного газа при постоянном давлении:
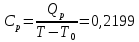
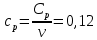
Определение CV теплоемкости и cV молярной теплоемкости двухатомного газа при постоянном объеме:
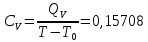
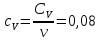
Определение γ постоянной адиабаты:
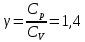
Определение iчисла степеней свободы молекул газов:
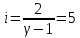
3. Трехатомный газ: V0=70, p0=200, ν=1,8
Таблица 4
| Т, К | 300 | 400 | 500 | 600 | 700 | 800 |
| QV,кДж | 4,49 | 8,97 | 13,46 | 17,95 | 22,44 | 26,92 |
| Qр,кДж | 5,98 | 11,97 | 17,95 | 23,93 | 29,92 | 35,90 |
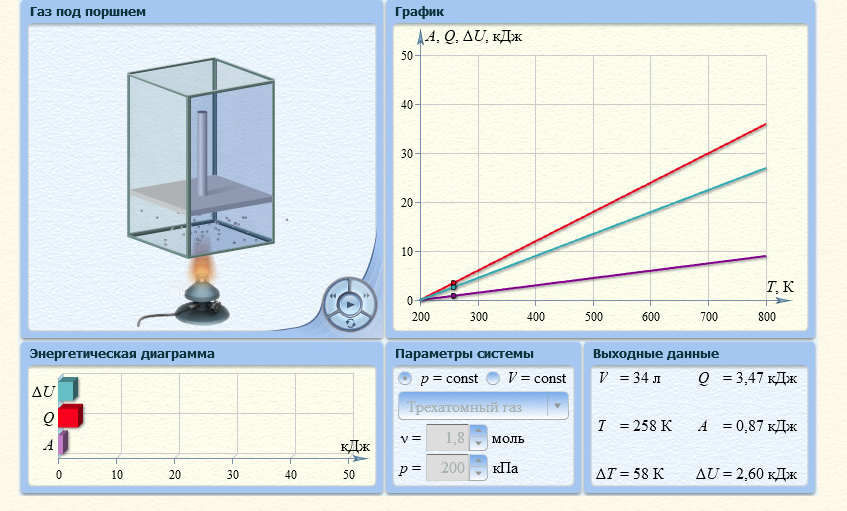
Графики зависимостей QV=f(T) и Qp=f(T) для трехатомного газа (на одном чертеже) по табл.4:
Определение Cp теплоемкости и cp молярной теплоемкости трехатомного газа при постоянном давлении:
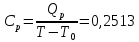
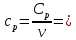 0,14
0,14Определение CV теплоемкости и cV молярной теплоемкости трехатомного газа при постоянном объеме:
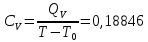
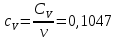
Определение γ постоянной адиабаты:
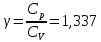
Определение iчисла степеней свободы молекул газов:
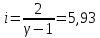
Вывод:
Работа выполнена

