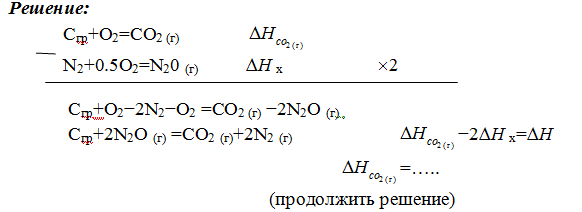Файл: Закон Гесса. Уравнение Кирхгофа. Примеры решения задач Закон Гесса. Уравнение Кирхгофа Закон Гесса. Уравнение Кирхгофа Применение первого закона термодинамики к химическим процессам относится к самостоятельному разделу науки.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.04.2024
Просмотров: 5
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Лекция. Закон Гесса. Уравнение Кирхгофа. Примеры решения задач
Закон Гесса. Уравнение Кирхгофа
Закон Гесса. Уравнение Кирхгофа
Применение первого закона термодинамики к химическим процессам относится к самостоятельному разделу науки – термохимии, с помощью которой оказалось возможным решение таких практически важных вопросов, как определение тепловых эффектов реакций и их зависимости от параметров, при которых реакции протекают.
Любой химический процесс может быть при необходимых условиях доведен до некоторого, внешне стабильного состояния равновесия. Для одной и той же реакции состояние равновесия зависит от ряда условий и прежде всего от температуры [1, 2].
Химические реакции можно разделить на экзотермические, протекают с выделением тепла, и эндотермические – с поглощением тепла.
Под тепловым эффектом реакции понимается количество тепла, выделяющееся (экзотермические реакции) или поглощающегося (эндотермические реакции) при неизменных параметрах v и Т или при неизменных р и Т, и при условии, что системой может производиться только работа расширения (dA=pdv)
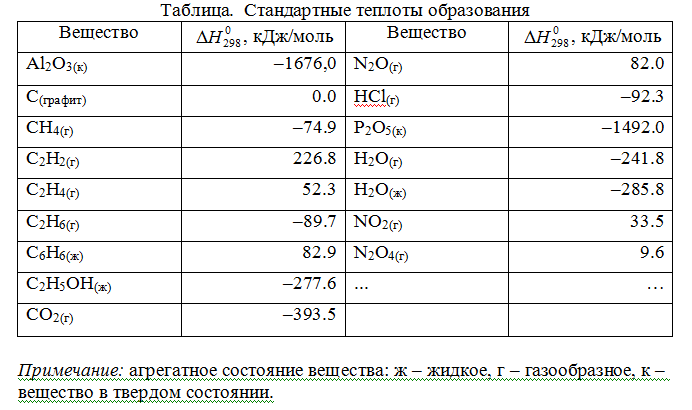
Применим первый закон термодинамики для анализа химических реакций, проходящих при v=constили p=const:
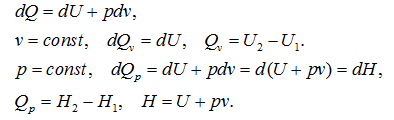
Из приведенных уравнений можно видеть, что тепловой эффект изохорно-изотермической реакции определяется изменением внутренней энергии системы, а тепловой эффект изобарно-изотермической реакции – изменением энтальпии системы. В основе термохимии лежит закон Гесса.
Закон Гесса:
тепловой эффект реакции, состоящей из нескольких промежуточных стадий не зависит от этих промежуточных стадий или их последовательности, а определяется начальным и конечным состоянием системы
.
Важной характеристикой любого сложного вещества является его стандартная теплота образования из простых веществ:
Эти теплоты приводятся в справочной литературе (например, Справочник по химии Л.И. Блинов и др., [3]).
Все вещества находятся в стандартном состоянии при р=1 атм и Т=298К. Теплота образования вещества при стандартных условиях обозначается так:
Следствия из закона Гесса.
1 Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции.
2. Тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом их стехиометрических коэффициентов (νi):
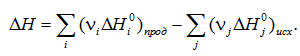
3. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (νi):
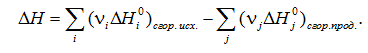
Связь между тепловыми эффектами
реакцииQp и Qv
Если газообразные реагирующие вещества можно считать идеальными газами, то между изохорическим и изобарическим тепловым эффектами существует связь:
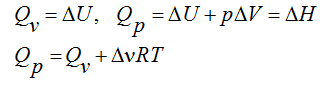
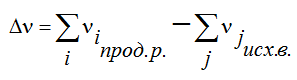
Пример 1.
Определить тепловой эффект реакции
CO(г)+0.5O2 (г)=CO2 (г)
при постоянном давлении Qpи температуре Т=293 К, если тепловой эффект этой реакции при постоянном объеме и той же температуре Qv= –284 кДж.
Решение:
Изменение числа молей газообразных продуктов в ходе реакции:
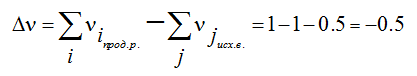
Тогда
Реакция сопровождается уменьшение газообразных участников реакции
∆ν= – 0,5.
При этом δA<0, Qp>Qv..
Пример 2.
Определить разность тепловых эффектов Qp и Qv реакции
2C(т)+O2 (г)=2CO (г),
если она протекает при 0˚С. Газы считать идеальными.
Решение:
Qp–Qv=∆ν∙RT, ∆ν=2 – 1=1,
Qp–Qv=8,31∙273,15≈2,27 кДж.
Следует отметить, что ∆ν = + 1, происходит увеличение объема газообразных веществ в ходе реакции. При этом δA>0, Qp<Qv..
Уравнение Кирхгофа
При решении практических задач бывает необходимо знать тепловые эффекты реакций при высоких температурах, в то время как таблицы термохимических величин содержат стандартные тепловые эффекты, относящиеся к температуре 25 ºС (298 К). Согласно первому началу термодинамики можно определять зависимость тепловых эффектов от температуры и произвести соответствующие пересчеты.
Изменение теплового эффекта химической реакции в зависимости от температуры выражается уравнением Кирхгофа
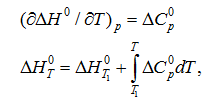
где
продуктов реакции и исходных веществ, взятых с учетом стехиометрических
коэффициентов
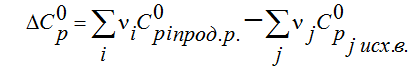
Пример 3.
Определить
H2 (г)+0.5 O2 (г)=H20(г)
при Т=2273 К, если известны тепловой эффект реакции при Т1=273 К кДж/моль и средние теплоемкости веществ (кДж/(моль К) при Т=2273 К:
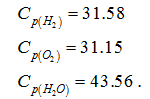
Решение:
Согласно уравнению Кирхгофа
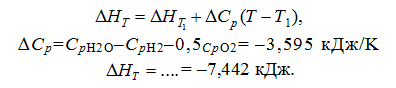
Пример 4.
Исходя из теплоты образования CO2 (г)
и термохимического уравнения
Cгр+2N2O (г) =CO2 (г)+2N2 (г), ∆H= –557.3 кДж
Вычислить теплоту образования N2O (г .