ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.04.2024
Просмотров: 7
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
| Тема 2.3. Свойства паров Испарение и конденсация. Насыщенный пар и его свойства. Абсолютная и относительная влажность воздуха. Точка росы. Кипение. Зависимость температуры кипения от давления. Перегретый пар и его использование в технике. Тема 2.4. Свойства жидкостей Характеристика жидкого состояния вещества. Поверхностный слой жидкости. Энергия поверхностного слоя. Явления на границе жидкости с твердым телом. Капиллярные явления. Тема 2.5. Свойства твердых тел Характеристика твердого состояния вещества. Упругие свойства твердых тел. Закон Гука. Механические свойства твердых тел. Тепловое расширение твердых тел и жидкостей. Плавление и кристаллизация. |
Глава 6. Стр. 147- 171 сделать сравнительную таблицу.
Свойства паров, жидкостей и твердых тел.
Парообразование (испарение и кипение). Конденсация. Удельная теплота парообразования. Насыщенный и ненасыщенный пар, их свойства. Влажность воздуха и ее измерение.
Плавление и отвердевание тел. Удельная теплота плавления. Удельная теплота сгорания топлива. Уравнение теплового баланса для простейших тепловых процессов.
Поверхностное натяжение жидкостей. Сила поверхностного натяжения. Смачивание. Капиллярные явления.
Кристаллические и аморфные тела. Механические свойства твердых тел. Виды деформаций. Модуль Юнга.
-
Парообразование (испарение и кипение). Конденсация. Удельная теплота парообразования.
Жидкое состояние вещества характеризуется ближним порядком расположения молекул. Из-за малой сжимаемости жидкости сохраняют свой объем, благодаря текучести принимают форму сосуда.
Парообразование – процесс перехода вещества из жидкого состояния в газообразное, сопровождающийся поглощением энергии.
Испарение – вид парообразования, происходит с поверхности жидкости при любой температуре. Интенсивность испарения зависит от:
-
площади поверхности жидкости; -
температуры жидкости; -
наличия ветра.
Кипение – процесс интенсивного парообразования, происходящий по всему объему жидкости при постоянной температуре, называемой температурой кипения.
Условие кипения: кипение происходит при температуре, когда давление насыщенного пара жидкости становится равным атмосферному или немного превышает его.
Температура кипения зависит от:
-
давления газа над поверхностью жидкости; -
наличия примесей.
Кипение наступает при определенной температуре лишь тогда, когда жидкость содержит маленькие пузырьки растворенного в ней воздуха или другого газа. Если таковые отсутствуют (жидкость предварительно очищена длительным кипячением), то жидкость можно нагреть до температуры более высокой, чем обычная точка кипения. Такая жидкость называется перегретой.
Конденсация – процесс перехода вещества из газообразного состояния в жидкое, сопровождается выделением энергии.
Удельная теплота парообразования – скалярная физическая величина, характеризующая способность вещества к испарению; численно равна количеству теплоты, необходимому для преобразования единицы массы жидкости в пар при температуре её кипения.
Количество теплоты, необходимое для испарения массы т жидкости, вычисляется по формуле:
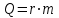 , где r – удельная теплота парообразования.
, где r – удельная теплота парообразования.B системе SI:
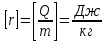 .
.Удельная теплота конденсации равна удельной теплоте парообразования.
-
Насыщенный и ненасыщенный пар, их свойства.
Динамическое равновесие пара и жидкости – состояние, при котором число молекул, вылетающих из жидкости в единицу времени, равно числу молекул, возвращающихся в нее за то же время.
Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным.
Свойства насыщенного пара:
-
насыщенный пар имеет при данной температуре наибольшее число молекул в единице объема (наибольшую плотность) и оказывает наибольшее давление. -
давление насыщенного пара при неизменной температуре – величина постоянная (закон Гей-Люссака неприменим, т.к. объем не зависит от температуры); -
давление насыщенного пара не зависит от его объема; -
концентрация молекул насыщенного пара в закрытом объеме с жидкостью неизменна при данной температуре, независимо от занимаемого объема; -
давление насыщенного пара возрастает с повышением температуры; -
законы Бойля-Мариотта и Шарля к насыщенному пару неприменимы вследствие изменения массы газа при изобарическом и изотермическом процессах.
Пар, не находящийся в динамическом равновесии со своей жидкостью, называют ненасыщенным.
Ненасыщенным будет пар над поверхностью жидкости, если испарение преобладает над конденсацией. Плотность ненасыщенного пара меньше, чем плотность насыщенного пара.
С
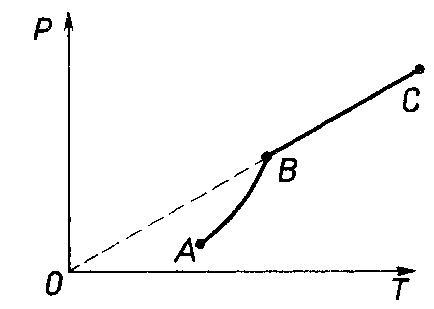 остояние насыщенного пара приближенно описывается уравнением состояния идеального газа, его давление определяется формулой
остояние насыщенного пара приближенно описывается уравнением состояния идеального газа, его давление определяется формулой 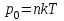 .
.К участку АВ данный закон неприменим, т.к. в закрытом сосуде возрастает концентрация молекул пара, меняется масса пара.
Когда вся жидкость испарится, пар при дальнейшем нагревании перестает быть насыщенным и его давление при постоянном объеме будет возрастать прямо пропоционально абсолютной температуре – участок ВС.
Критическая температура – это температура, при которой исчезают различия в физических свойствах между жидкостью и ее насыщенным п
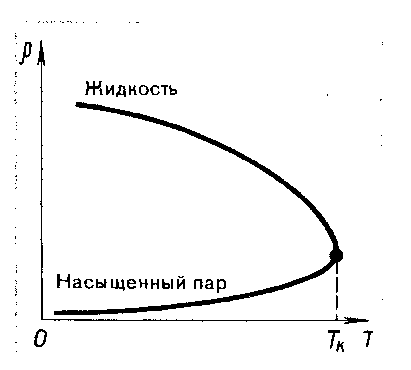 аром.
аром.При температуре выше критической ни при каких давлениях газ нельзя обратить в жидкость.
-
Влажность воздуха и ее измерение.
Парциальным давлением водяного пара называют давление, которое оказывал бы водяной пар, если бы другие газы в смеси отсутствовали.
Абсолютная влажность воздуха – скалярная физическая величина, характеризующая количество водяного пара, содержащегося в 1 м3сухого воздуха.
Абсолютная влажность воздуха измеряется количеством водяного пара (в граммах), содержащегося в 1 м3сухого воздуха:
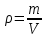 .
.Относительная влажность воздуха – скалярная физическая величина, численно равная отношению абсолютной влажности к количеству пара, необходимого для насыщения 1 м3воздуха при той же температуре:
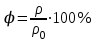 ;
;из уравнения Менделеева-Клапейрона
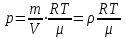 , то есть p ρ:
, то есть p ρ: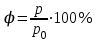 ,
,где
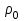 и
и 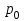
плотность и давление насыщенного пара при данной температуре соответственно.
Снижением температуры можно довести относительную влажность воздуха до 100%, не изменяя количество водяного пара в нем.
Температуру, при которой относительная влажность воздуха становится равной 100% (воздух оказывается насыщенным водяным паром), называют точкой росы.
Приборы для определения относительной влажности воздуха:
-
конденсационный гигрометр; -
волосяной гигрометр; -
психрометр.
-
Плавление и отвердевание тел. Удельная теплота плавления. Удельная теплота сгорания топлива. Уравнение теплового баланса для простейших тепловых процессов.
Твердыми в физике считают тела, имеющие дальний порядок распределения молекул (кристаллическую решетку) и определенную температуру плавления.
Плавление – процесс перехода вещества из твердого (кристаллического) состояния в жидкое, происходящий при постоянной температуре (при неизменном давлении) – температуре плавления, сопровождающийся поглощением энергии.
При нагревании твердого тела, с приближением к температуре плавления, силы притяжения между молекулами кристалла уменьшаются настолько, что начинает разрушаться кристаллическая решетка – происходит переход вещества в жидкое состояние. После достижения температуры плавления вся подведенная к телу энергия идет на увеличение потенциальной энергии молекул и преодоление связей между ними, а кинетическая энергия молекул и температура тела остаются неизменной.
Удельная теплота плавления – скалярная физическая величина, численно равная количеству теплоты, необходимому для превращения 1 кг кристаллического вещества при температуре плавления в жидкость при той же температуре.
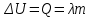 ; в системе SI:
; в системе SI: 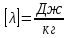 .
.Удельная теплота сгорания топлива q – скалярная физическая величина, численно равная количеству теплоты, выделившемуся при полном сгорании 1 кг топлива.
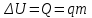
; в системе SI:
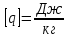 .
.Уравнение теплового баланса:
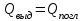 - при отсутствии потерь;
- при отсутствии потерь; – при наличии потерь.
– при наличии потерь.-
П оверхностное натяжение жидкостей. Сила поверхностного натяжения.
оверхностное натяжение жидкостей. Сила поверхностного натяжения.
Поверхность - это граница между двумя контактирующими средами. Поверхность жидкости - это граница между жидкостью и газом (насыщенным паром вещества жидкости).
Молекулы, находящиеся в поверхностном слое жидкости, имеют меньшее число соседей, нежели молекулы, находящиеся в объеме. Поэтому они испытывают действие не скомпенсированных, направленных вовнутрь сил притяжения со стороны остальной части жидкости. Это является причиной того, что поверхностный слой оказывает на всю жидкость большое внутреннее давление.
Для изотермического перехода молекулы из объема на поверхность последняя должна выполнить работу против сил внутреннего давления. Поэтому потенциальная энергия молекулы в поверхностном слое больше, чем в объеме. Требование минимума потенциальной энергии в условиях равновесия достигается минимизацией поверхности.
Для изотермического увеличения поверхности на малую величину ΔS надо выполнить работу А. Эта работа пропорциональна ΔS:
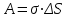 .
.Коэффициент поверхностного натяжения (σ) – скалярная физическая величина, являющаяся основной термодинамической характеристикой поверхности; численно равна минимальной работе, которую необходимо выполнить, чтобы образовать 1 м2 новой поверхности:
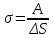 , в системе SI:
, в системе SI: 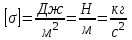 .
.Е
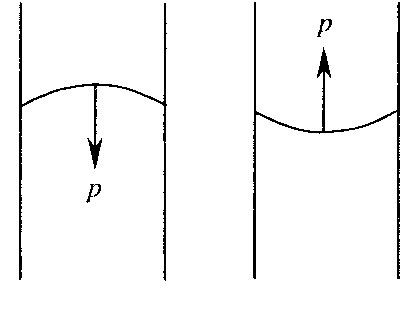 сли поверхность жидкости ограничена периметром смачивания, то
сли поверхность жидкости ограничена периметром смачивания, то 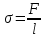 ,
,где l


