Файл: Институт нефтепереработки и нефтехимии фгбоу во угнту в г. Салавате.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.04.2024
Просмотров: 11
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Уфимский государственный нефтяной технический университет» (ФГБОУ ВО УГНТУ)
Институт нефтепереработки и нефтехимии ФГБОУ ВО УГНТУ в г. Салавате
Кафедра «Информационных технологий»
Физика
РАСЧЕТНО-ГРАФИЧЕСКАЯ РАБОТА
Молекулярная физика. Термодинамика.
ИнТех- 09.03.01 – 1.02.09 РГР
Исполнитель:
студент гр. БАБз - 22-21 Юрлов Р. В.
Руководитель:
ассистент Г.Ф. Шаяхметов
Салават
2023
2.9. Определить относительную молекулярную массу
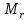 :
: 1) воды,
2) углекислого газа,
3) поваренной соли.
Дано:
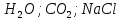
Найти:
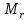
Решение.
1) Одна молекула
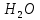 состоит из одного атома кислорода и двух атомов водорода. Молярная масса кислорода
состоит из одного атома кислорода и двух атомов водорода. Молярная масса кислорода 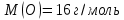 , а водорода
, а водорода 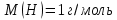 . Тогда молярная масса молекулы
. Тогда молярная масса молекулы 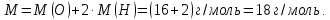
Поэтому относительная молекулярная масса равна
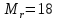 .
.2) Одна молекула
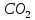 состоит из одного атома углерода и двух атомов кислорода. Молярная масса углерода
состоит из одного атома углерода и двух атомов кислорода. Молярная масса углерода 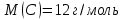 , а кислорода
, а кислорода 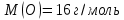 . Тогда молярная масса молекулы
. Тогда молярная масса молекулы 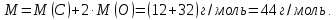
Поэтому относительная молекулярная масса равна
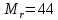
.
3) Одна молекула
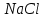 состоит из одного атома натрия и одного атома хлора. Молярная масса натрия
состоит из одного атома натрия и одного атома хлора. Молярная масса натрия 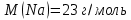 , а хлора
, а хлора 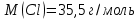 . Тогда молярная масса молекулы
. Тогда молярная масса молекулы 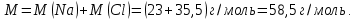
Поэтому относительная молекулярная масса равна
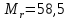 .
.Ответ:
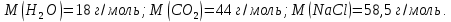
2.19. Определить плотность
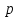 водяного пара, находящегося под давлением
водяного пара, находящегося под давлением 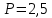 кПа и имеющего температуру
кПа и имеющего температуру 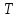 = 250К.
= 250К.Дано:_СИ'>Дано:
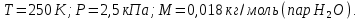
СИ:
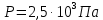
Найти:
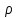
Решение.
Воспользуемся уравнением Клапейрона – Менделеева, применив его к пару:
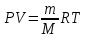
где
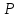 – давление пара, Па;
– давление пара, Па;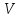 - объем,
- объем, 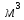 ;
;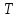 – температура газа, К;
– температура газа, К;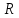 – молярная газовая постоянная (8,31Дж/(моль·К)).
– молярная газовая постоянная (8,31Дж/(моль·К)).Откуда
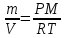 .
.Нам известно, что плотность
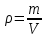
Поэтому
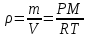
Проверим размерности расчетных формул
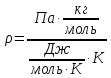
Подставляя числовые значения получим ответ
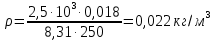
Ответ:
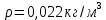
2.29. В азоте взвешены мельчайшие пылинки, которые движется так, как если бы они были очень крупными молекулами. Масса каждой пылинки равна 6
 г. Газ находится при температуре
г. Газ находится при температуре  = 400 К. Определить средние квадратичные скорости
= 400 К. Определить средние квадратичные скорости 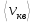 , а также средние кинетические энергии
, а также средние кинетические энергии 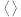 поступательного движения молекулы азота.
поступательного движения молекулы азота.Дано:
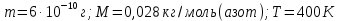
СИ:
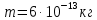
Найти:
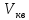 ;
; 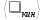 .
.Решение.
По определению среднеквадратичная скорость
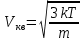
где
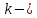 постоянная Больцмана (1,38
постоянная Больцмана (1,38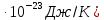 ;
;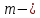 масса пылинки, кг.
масса пылинки, кг.Поэтому скорость пылинки
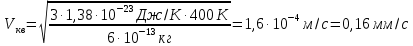
С другой стороны среднеквадратичная скорость
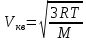
где
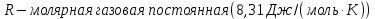 ;
;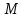 -молярная масса газа.
-молярная масса газа.Поэтому скорость молекул азота
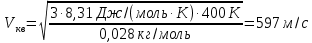
Средняя кинетическая энергия поступательного движения одной молекулы
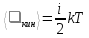
Где
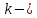 постоянная Больцмана (1,38
постоянная Больцмана (1,38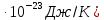 ;
;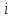
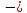 поступательные степени свободы молекулы (в нашем случае
поступательные степени свободы молекулы (в нашем случае 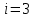 , т.к. возможны три поступательных движения).
, т.к. возможны три поступательных движения).Поэтому
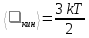
Средняя энергия поступательно движения пылинки равна
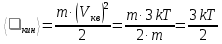
Видно, что средние кинетические энергии пылинки и молекул азота равны друг другу
Проверим размерности расчетных формул
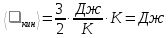
Подставляя числовые значения получим ответ
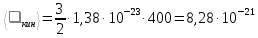 Дж
ДжОтвет:_Дж1.39.'>Ответ:
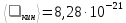 Дж
Дж1.39. Одноатомный газ при нормальных условиях занимает объем
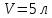 . Вычислить теплоемкость
. Вычислить теплоемкость 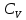 этого газа при постоянном объеме.
этого газа при постоянном объеме.Дано:
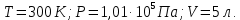
СИ:
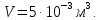
Найти:
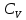 .
.Решение.
Изохорная теплоемкость равна
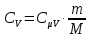
где
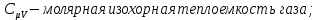
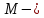 молекулярная масса газа, кг.
молекулярная масса газа, кг.Воспользуемся уравнением Клапейрона – Менделеева:
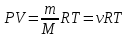
где
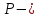 давление, Па;
давление, Па;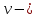 количество молей;
количество молей;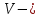 объем сосуда,
объем сосуда, 
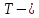 температура газа, К;
температура газа, К;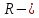
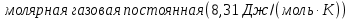 .
.Откуда
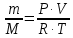
Поэтому
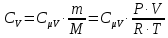
С другой стороны, молярная теплоемкость при постоянном объеме равна
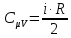
где
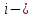
число степеней свободы (в нашем случае число степеней свободы равно 3 (3 поступательные и ни одной вращательной, т.к. газ одноатомный));
 .
.тогда
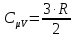
Подставим
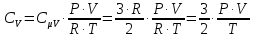
Проверим размерности расчетных формул
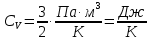
Подставляя числовые значения получим ответ
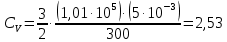 Дж/К
Дж/КОтвет:
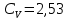 Дж/К
Дж/К2.49. Определить количество теплоты
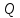 , которое надо сообщить кислороду объемом
, которое надо сообщить кислороду объемом 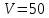 л при его изохорном нагревании, чтобы давление газа повысилось на
л при его изохорном нагревании, чтобы давление газа повысилось на 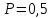 МПа.
МПа.Дано:
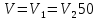 л;
л; 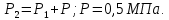
СИ:
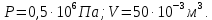
Найти:
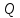
Решение.
Количество тепла
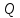 , необходимое для изохорного нагрева газа определяется:
, необходимое для изохорного нагрева газа определяется: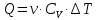
Где
 количество молей газа;
количество молей газа;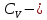 молярная изохорная теплоемкость;
молярная изохорная теплоемкость;Молярная изохорная теплоемкость вычисляется:
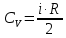
где
 число степеней свободы газа (в нашем случае i=5, т.к. кислород – газ двухатомный (3 поступательные и 2 вращательные степени свободы)
число степеней свободы газа (в нашем случае i=5, т.к. кислород – газ двухатомный (3 поступательные и 2 вращательные степени свободы)поэтому
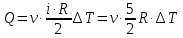
Воспользуемся уравнением Клапейрона – Менделеева, применив его к газу:

