Файл: Пермский национальный исследовательский политехнический университет.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 21
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2. Гальванический элемент
Электродные потенциалы металлов рассчитываются по уравнению Нернста:
φ Mеn+/Me = φ0Mеn+/Me +
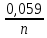 · lg CMen+
· lg CMen+ где φ0Mеn+/Me – величина стандартного электродного потенциала, (В).
Электродвижущая сила процесса:
ЭДС = φ катода – φанода
Задание:
-
Рассчитайте электродные потенциалы металлов по уравнению Нернста. -
Определите анод и катод. Рассчитайте ЭДС гальванического элемента. -
Напишите электродные процессы и общую токообразующую реакцию. -
Напишите схему гальванического элемента и укажите направление движения электронов по внешней цепи.
Стандартные электродные потенциалы (приложение 6).
Таблица 10.
| № задания | Электроды | Концентрация электролита моль/л |
| 331 | Cu/CuCl2; Zn/ ZnCl2 | CCu2+= 0,2; CZn2+=10-4 |
| 332 | Cu/CuSO4; Co/CoSO4 | CCu2+= 0,1; CCo2+=10-3 |
| 333 | Fe/FeCl2; Mg/MgCl2 | CFe2+ = 0,2; CMg2+= 0,001 |
| 334 | Cu/CuCl2 ; Cd /CdCl2 | CCu2+= 0,1; CCd2+= 0,002 |
| 335 | Ag/AgNO3; Zn/Zn(NO3)2 | CAg+= 0,2; CZn2+= 0,001 |
| 336 | Pb/Pb(NO3)2; Mg/Mg(NO3)2 | CPb2+= 0,1; CMg2+= 10-4 |
| 337 | Al/Al2(SO4)3; Sn/ SnSO4. | CAl3+ = 0,01; CSn2+= 0,5 |
| 338 | Ag/AgNO3; Co/Co(NO3)2 | CAg+= 0,5; CCo2+= 0,001 |
| 339 | Al/Al2(SO4)3; Au/Au2(SO4)3 | CAl3+= 10-4; CAu3+= 0,25 |
| 340 | Pt/PtCl2; Ni/Ni(NO3)2 | CPt2+= 0,45; CNi2+= 0,01 |
| 341 | Sn/SnCl2; Pb /Pb(NO3)2 | CSn2+= 10-5; CPb2+= 0,5 |
| 342 | Mn/MnSO4; Zn/ZnSO4 | CMn2+= 0,2; CZn2+= 0,001 |
| 343 | Ag/AgNO3; Co/Co(NO3)2 | CAg+= 0,5; CCo2+= 0,001 |
| 344 | Al/Al2(SO4)3; Pt/ PtSO4 | CAl3+= 10-4; CPt3+ = 0,25 |
| 345 | Pt/PtCl2; Cr/CrSO4 | CPt2+= 0,5; CCr2+ = 0,02 |
| 346 | Sn/SnCl2; Pb /Pb(NO3)2 | CSn2+= 10-5; CPb2+= 0,5 |
| 347 | Ni/NiSO4; Cu /CuSO4 | CNi2+= 0,001; CCu2+= 0,5 |
| 348 | Ag/AgNO3; Cd/Cd(NO3)2 | CAg+= 0,1; CCd2+= 0,002 |
| 349 | Sn/Sn(NO3)2; Fe/Fe(NO3)3 | CSn2+= 0,005; CFe3+= 0,1 |
| 350 | Pb/Pb(NO3)2; Fe/Fe(NO3)2 | CPb2+= 0,05; CFe2+= 0,2 |
| 351 | Ni/NiSO4; Cu/CuSO4 | CNi2+= 0,001; CCu2+= 0,5 |
| 352 | Ag/AgNO3; Cd/Cd(NO3)2 | CAg+= 0,1; CCd2+= 0,002 |
| 353 | Sn/Sn(NO3)2; Zn/Zn(NO3)2 | CSn2+= 0,05; CZn2+= 0,1 |
| 354 | Pb/Pb(NO3)4 ; Fe/Fe(NO3)2 | CPb4+= 0,002; CFe2+= 0,2 |
| 355 | Ag/AgNO3; Mn/MnSO4 | CAg+= 0, 1; CMn2+ = 0,01 |
| 356 | Cr/CrSO4; Cd/CdSO4 | CCr2+ = 0,01; CCd2+=0,001 |
| 357 | Ag/AgNO3; Mg /Mg(NO3)2 | CAg+= 0,1; CMg2+= 0,2 |
| 358 | Zn/ZnSO4 ; Fe/Fe(NO3)2 | CZn2+= 0,2; CFe2+= 0,02 |
| 359 | Ag/AgNO3 ; Ni/Ni(NO3)2 | CAg+= 0,001; CNi2+= 0,15 |
| 360 | Sn/SnCl2 ; Co/CoCl2 | CSn2+= 0,1; CCo2+= 0,025 |
3. Электрохимическая коррозия металлов
Причина электрохимической коррозии состоит в том, что поверхность металла всегда является энергетически неоднородной из-за наличия примесей в металлах, различий по химическому и фазовому составу сплава. Это приводит к образованию на поверхности во влажной атмосфере микрогальванических элементов. На участках металла, имеющих более отрицательные значения потенциала, происходит процесс окисления этого металла:
Me0 + ne = Men+ (анодный процесс).
Окислители, принимающие электроны у катода, называются катодными деполяризаторами.
Наиболее часто встречаются окислители (деполяризаторы):
- ионы водорода (коррозия с водородной деполяризацией);
уравнение восстановительного процесса:
2Н+ + 2ē = Н2 (в кислой среде),
2 H2O + 2ē = Н2 + 2OH– (в нейтральной и щелочной средах);
- молекулы кислорода (коррозия с кислородной деполяризацией); уравнение восстановительного процесса:
O2 + 4ē + 4Н+ = 2 H2O (в кислой среде);
O2 + 4ē + 2 H2O = 4 OH– (в нейтральной и щелочной средах);
На катодных участках поверхности происходит восстановление окислителей.
Катодные процессы при коррозии
Таблица 11.
| № | Электрохимический процесс | Е, В | рН |
| 1 | 2Н2О +2e = 2OH- + H2 | E02H2O/H2 + OH- = – 0,413 | рН≥7 |
| 2 | 2H+ + 2e = H2 | E02H+ /H2 = 0 | pH<7 |
| 3 | O2 + 2Н2О +4e = 4OH- | E0O2 + 2H2O/4OH- = 0,827 | рН≥7 |
| 4 | O2 + 4H+ + 4e = 2H2O | E0O2 + 4H+ /2H2O = 1,228 | pH<7 |
Задание:
-
Рассмотрите коррозию гальванопары. Укажите анод и катод соответствующей гальванопары. -
Рассчитайте ЭДС. -
Напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе. -
Окислительно-восстановительные потенциалы водорода, кислорода и металлов в разных средах (приложение 7).
Таблица 12.
| Коррозионная среда | |||||
| № задания | Н2О + О2 | № задания | NaOH + Н2О | № задания | Н2О + Н+ |
| 361 | Fe / Ni | 371 | Zn / Sn | 381 | Sn / Cu |
| 362 | Cu / Zn | 372 | Fe / Al | 382 | Fe / Zn |
| 363 | Zn / Al | 373 | Cr / Zn | 383 | Pb / Zn |
| 364 | Fe / Zn | 374 | Ni /Cd | 384 | Fe / Mg |
| 365 | Co / Mg | 375 | Fe / Cu | 385 | Cd / Cr |
| 366 | Pb / Fe | 376 | Cd / Cr | 386 | Al / Ni |
| 367 | Zn / Sn | 377 | Mg / Cd | 387 | Fe / Cu |
| 368 | Ni / Sn | 378 | Fe / Mg | 388 | Pb / Al |
| 369 | Pb / Cr | 379 | Pb / Cr | 389 | Sn / Zn |
| 370 | Bi / Cu | 380 | Sn / Zn | 390 | Co / Al |
4. Электролиз водных растворов солей
1. Процессы на катоде
Процесс на катоде зависит от активности катионов металлов, от характера среды, в которой происходит электролитический процесс.
При электролизе водных растворов все металлы можно разделить на три группы:
1. Металлы, стоящие в ряду напряжений от Li по Al, не восстанавливаются на катоде из водных растворов солей. Катионы этих металлов обладают очень низкой окислительной способностью. На катоде идет процесс восстановления воды и образования основания у катодного пространства.
2. Металлы, находящиеся в ряду стандартных электродных потенциалов между Mn и H, восстанавливаются на катоде одновременно с выделением водорода.
3. Металлы, стоящие в ряду стандартных потенциалов за водородом (медь, серебро, золото и др.), восстанавливаются на катоде без сопровождения выделения водорода. Катионы этих металлов обладают более высокой окислительной способностью, чем ионы водорода.
Таблица 13.
| 1 | 2 | | 3 |
| Li, K, Ba, Ca, Na, Mg,Al | Mn, Cr, Zn, Fe, Ni, Sn, Pb | H | Cu, Hg, Ag, Pt, Au |
| 2Н2О + 2е = Н2 + 2ОН- Men+ +n ОН- = Me(OH)n | 2Н2О + 2е = Н2 + 2ОН- Men+ +ne = Me0 | | Men+ +ne = Me0 |
Процесс на катоде рассчитывается математически:
-
Равновесный потенциал металла рассчитывается по уравнению Нернста: φравн Mеn+/Me = φ0Mеn+/Me +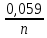 ·lg CMen+
·lg CMen+
Реальный потенциал металла:
φi Mеn+/Me ≈ φравн Mеn+/Me
2. Равновесный потенциал восстановления водорода зависит от рН среды и парциального давления водорода (РН2).
φравн2Н+/Н2 = – 0,059 · рН – 0,0295· lg РН2
РН2= 5·10-7 атм
Реальный потенциал разряда водорода на катоде
φi2Н+/Н2 = φравн2Н+/Н2 –
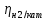
3. Процесс восстановления на катоде зависит от реальных потенциалов металла и водорода:
а) если φi2Н+/Н2 > φi Mеn+/Me , то на К(-): 2Н2О + 2е = Н2 + 2ОН-
Men+ +n ОН- = Me(OH)n
б) если φi2Н+/Н2 < φi Mеn+/Me , то на К(-): Men+ +ne = Me0
в) если φi2Н+/Н2 ≈ φi Mеn+/Me, то на К(-): 2Н2О + 2е = Н2 + 2ОН-
Men+ +ne = Me
0
2. Процессы на аноде
Процесс окисления на аноде зависит от материала анода.
Процесс на инертном (нерастворимом) аноде (угольном, графитовом, золотом, платиновом).
На аноде в первую очередь окисляются анионы с меньшим потенциалом.
Таблица 14.
| I- , Br-, S2-, Cl- | OH- | SO42-, NO3-, F-, PO43- |
| Окисляются на аноде до простых веществ 2I⎯ - 2e → I2º 2Br⎯ - 2e → Br2º 2Cl⎯ - 2e → Cl2º | | Не окисляются на аноде. Окисляется вода и у анодного пространства образуется кислота 2H2O + 4e → О2º + 4H+ Например, 2H+ + SO42-= Н2SO4 |


