Файл: Газовые законы. Уравнение состояния идеального газа.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 10
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ОГАПОУ «Белгородский индустриальный колледж»
План занятия № 13
Учебные группы: 11 ТТО, 11 ПКС
Тема занятия: Газовые законы. Уравнение состояния идеального газа.
Вид занятия - смешанный.
Тип занятия комбинированный.
Учебные цели занятия: Установить зависимость между параметрами, определяющими состояние газа. Сформулировать законы для изопроцессов в газе.
Задачи занятия:
Обучающая: Установить зависимость между параметрами, определяющими состояние газа. Сформулировать законы для изопроцессов в газе.
Развивающая: Развитие мыслительной деятельности учащихся с помощью анализа и сравнения типов соединений, обобщения изучаемых фактов. Развитие устной речи студентов.
Воспитательная: показать важность знаний о соединениях источников и законах тока для повседневной жизни.
Планируемые образовательные результаты:
В результате изучения темы обучающиеся должны
знать: зависимость между параметрами, определяющими состояние газа, законы для изопроцессов в газе.
уметь: Решать задачи на газовые законы
Ход занятия:
Организация начала урока. (2 минуты). Приветствие. Постановка цели:
I. Организация учебной деятельности учащихся на уроке.
Сообщение темы, цели, задач урока. Стимулирование мотивации учебной деятельности при обучении.
II. Проверка знаний и умений.
Организация самостоятельной работы.
III. Изучение нового материала.
Изложение нового материала сопровождается показом фрагментов изопроцессов [3]
Учитель: (вопросы для повторения)
1. Основное уравнение МКТ имеет вид:
2. Температура - мера средней кинетической энергии. Почему?
,
3. Как связана абсолютная шкала и шкала Цельсия?
Задача урока: охарактеризовать состояние идеального газа через макропараметры (p, V, T)
Учитель:
Запишем зависимость давления газа от концентрации молекул и температуры
Из данного уравнения вытекает связь между давлением, объемом и температурой идеального газа, который может находиться в двух любых состояниях.
Рассмотрим систему , находящуюся в двух состояниях, с параметрами p, V, T.
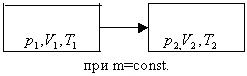
Запишем уравнения для двух состояний.
(Учащиеся самостоятельно делают вывод и формулируют определение).
Определение: при фиксированной массе отношение произведения давления и объема на температуру есть величина постоянная.
Учитель:
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трех параметров – давление, объем или температура – остаются неизменными.
Определение: количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессамия).
Рассмотрим каждый из процессов
Изотермический процесс
(процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре) [3]
сформулируем определение. (учащиеся формулируют самостоятельно)
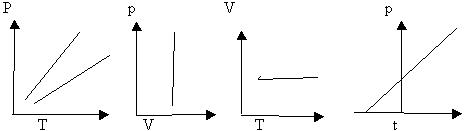
определение: для газа данной массы произведение давления на объем постоянна, если температура газа не меняется.- закон Бойля – Мариотта.
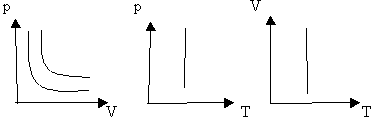
Рис 1.
Вывод: (учащиеся самостоятельно по первому рисунку)
изотерма соответствующая более высокой температуре
Изобарный процесс.
(процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении). [3]
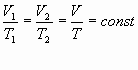
сформулируем определение.
Определение: для газа данной массы отношение объема к температуре постоянно, если давление не изменяется.
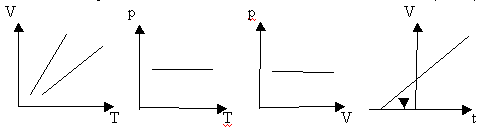
Рис. 2
Вывод: (самостоятельно по рисунку 2)
изобара соответствующая более высокому давлению
Изохорный процесс
(процесс изменения состояния термодинамической системы при постоянном объеме). [1]
сформулируем определение.
Определение: при данной массе газа отношение давление газа к температуре постоянно
, если объем газа не изменяется.- закон Шарля (1787г.)
Вывод: изохора соответствующая большему объему
Конспект в тетради:
Закон Бойля-Мариотта (изотермический закон)
Для газа данной массы произведение давления газа на его объем постоянно, если его температура газа не меняется.
| Название процесса | Постоянный параметр | Математическая запись закона | |
| Изотермичес-кий | T=const m=const N=const | pv=const p1 v1 p2 v2 | |
Графики изотермы
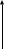

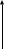 Р v T
Р v T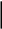



Т T v
Закон Гей-Люссака (1802 г)
Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
| Название процесса | Постоянный параметр | Математическая запись закона |
| изобарный | P=const m=const N=const | |
Графики изобары
Объем газа при температуре
Объем газа при 0оС
Температурный коэффициент объемного расширения


