Файл: Лабораторная работа 3 по дисциплине (учебному курсу) Физика1.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 12
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.

МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«Тольяттинский государственный университет»
(наименование института полностью)
Кафедра /департамент /центр1 _____________Техносферная безопасность____________
(наименование кафедры/департамента/центра полностью)
ЛАБОРАТОРНАЯ РАБОТА №__3_
по дисциплине (учебному курсу) «______Физика1_____________»
(наименование дисциплины (учебного курса)
Вариант __8__ (при наличии)
| Студент | Э.А. Закирова (И.О. Фамилия) | |
| Группа | ТБбп-2002бс | |
| Преподаватель | И. В. Мелешко (И.О. Фамилия) | |
Тольятти 2022
«Теплоемкость идеального газа»
Цель работы:
-
Знакомство с теплоемкостью идеального газа в изохорическом и изобарическом процессах. -
Экспериментальное подтверждение закономерностей изопроцессов. -
Экспериментальное определение количества степеней свободы и структуры молекул газа в данной модели.
Результаты измерений и расчетов:
1. Одноатомный газ: V0=_40*10-3м3, p0=_140*103Па, ν=_1,8 моль__
Таблица 2
| Т, К | 300 | 400 | 500 | 600 | 700 | 800 |
| QV,кДж | 3 | 5,73 | 8,71 | 11,47 | 14,33 | 17,06 |
| Qр,кДж | 4,96 | 9,74 | 14,52 | 19,29 | 23,59 | 28,67 |
*Значения абсолютной температуры может не совпадать с рекомендуемым, но должно быть близким по значению и одинаковым для Qp и QV в столбце.
Графики зависимостей QV=f(T) и Qp=f(T) для одноатомного газа (на одном чертеже) по табл.2.

Определение Cp теплоемкости и cp молярной теплоемкости газа при постоянном давлении:
 /K
/K
Определение CV теплоемкости и cV молярной теплоемкости газа при постоянном объеме:
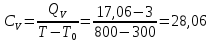 Дж/К
Дж/К =28,06/1,8=15,59
=28,06/1,8=15,59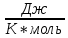
Определение γ постоянной адиабаты:
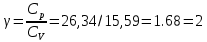
Определение iчисла степеней свободы молекул газов:
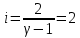
2. Двухатомный газ: V0=_40*10-3м3, p0=_140*103Па, ν=_1,8 моль__
Таблица 3
| Т, К | 300 | 400 | 500 | 600 | 700 | 800 |
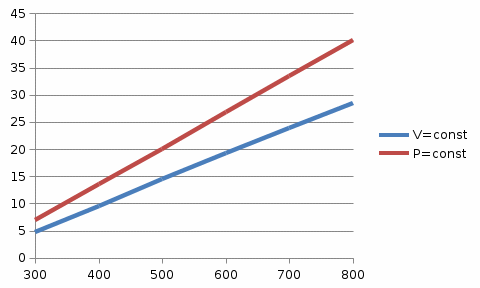
| QV,кДж | 4,78 | 9,56 | 14,52 | 19,29 | 23,89 | 28,44 |
| Qр,кДж | 6,95 | 13,64 | 20,07 | 26,76 | 33,45 | 40 |
Графики зависимостей QV=f(T) и Qp=f(T) для двухатомного газа (на одном чертеже) по табл.3:
Определение Cp теплоемкости и cp молярной теплоемкости двухатомного газа при постоянном давлении:
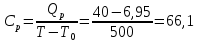
Дж/K
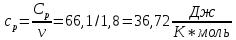
Определение CV теплоемкости и cV молярной теплоемкости двухатомного газа при постоянном объеме:
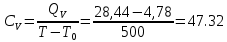
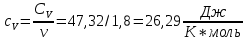
Определение γ постоянной адиабаты:
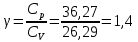
Определение iчисла степеней свободы молекул газов:
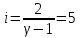
3. Трехатомный газ: V0=_40*10-3м3, p0=_140*103Па, ν=_1,8 моль__
Таблица 4
| Т, К | 300 | 400 | 500 | 600 | 700 | 800 |
| QV,кДж | 5,73 | 11,68 | 17,42 | 22,94 | 28,67 | 34,19 |
| Qр,кДж | 7,65 | 15,29 | 22,94 | 30,88 | 38,51 | 45,85 |
Графики зависимостей QV=f(T) и Qp=f(T) для трехатомного газа (на одном чертеже) по табл.4:

Определение Cp теплоемкости и cp молярной теплоемкости трехатомного газа при постоянном давлении:
 Дж/K
Дж/K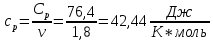
Определение CV теплоемкости и cV молярной теплоемкости трехатомного газа при постоянном объеме:
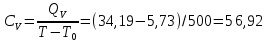 Дж/K
Дж/K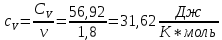
Определение γ постоянной адиабаты:

Определение iчисла степеней свободы молекул газов:
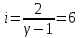
Вывод: Познакомилась с теплоемкостью идеального газа в изохорическом и изобарическом процессах, экспериментально подтвердила закономерности при изобарическом и изохорическом процессах и
вычислила теплоемкости для этих процессов, экспериментально определила количества степеней свободы и структуры молекул одноатомного, двухатомного и трехатомного газов в данной модели.
1 Оставить нужное
