Файл: Химическое равновесие. Влияние различных факторов на равновесие. Принцип ЛеШательеБрауна.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.10.2024
Просмотров: 6
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Краткосрочный план по химии
| Школа-лицей №5 | ФИО учителя: Шеховцова Н.С | Дата: 6.12.22 | Класс: 10А Количество: 29 | |||||||||||||||||||
| Раздел долгосрочного планирования: | 10.2C Химическое равновесие | |||||||||||||||||||||
| Тема урока | Химическое равновесие. Влияние различных факторов на равновесие. Принцип Ле-Шателье-Брауна. Лабораторная работа №3 "Изучение смещения динамического равновесия под действием различных факторов" | |||||||||||||||||||||
| Учебные цели | 10.3.3.1 прогнозировать влияние изменения температуры, концентрации и давления на химическое равновесие; 10.3.3.2 экспериментально изучать влияние различных факторов на смещение равновесия | |||||||||||||||||||||
| Цель урока | прогнозировать влияние изменения температуры, концентрации и давления на химическое равновесие; экспериментально изучать влияние различных факторов на смещение равновесия | |||||||||||||||||||||
| Критерии оценивания | прогнозируют влияние изменения температуры, концентрации и давления на химическое равновесие; экспериментально изучают влияние различных факторов на смещение равновесия | |||||||||||||||||||||
| Уровень мыслительной деятельности | знание, понимание, применение, анализ, синтез, оценка | |||||||||||||||||||||
| Ход урока | ||||||||||||||||||||||
| Этапы урока | Виды упражнений, запланированных на уроке | |||||||||||||||||||||
| Деятельность учителя | Деятельность учащихся | Оценивание | Ресурсы | |||||||||||||||||||
| Начало урока Психологический настрой 1 минут | К/Приветствие, проверка готовности к уроку учащихся, проверка отсутствующих. К/Психологический настрой Перспектива на урок | Диалог с дежурным, с классом. |
ФО/ Обратная связь учителя. Похвала. | Слайдовая презентация к уроку, этапы урока. | ||||||||||||||||||
| Повтори 10 минут | Организует тренинг по проверке теоретических заний. | ПО/ «Толстые вопросы» | ФО/ Обратная связь учителя. Похвала. Балл за правильный ответ – звёздочка. | §34-39 | ||||||||||||||||||
| Изучи 10 минут | Называет тему урока, знакомит с целями. Химическое равновесие. Влияние различных факторов на равновесие. Принцип Ле-Шателье-Брауна. Лабораторная работа №3 "Изучение смещения динамического равновесия под действием различных факторов" 10.3.3.1 прогнозировать влияние изменения температуры, концентрации и давления на химическое равновесие; 10.3.3.2 экспериментально изучать влияние различных факторов на смещение равновесия Организует работу по изучению нового материала. | К/ Записывают дату и тему урока в тетрадь. Смотрят видеоролик Лабораторная работа №3 "Изучение смещения динамического равновесия под действием различных факторов". Делают вывод. И/П/Г/ Бортовой журнал §39 Упр 1-5 стр 167 | ФО/ Обратная связь учителя. Похвала. КО/ 1 балл за два правильных ответа. КО/ прогнозируют влияние изменения температуры, концентрации и давления на химическое равновесие; 5 баллов | Учебник химии 10 класс, §39 https://www.youtube.com/watch?v=U187i1zmHpo | ||||||||||||||||||
| Задания на усвоение и закрепление 20 мин | Организует работу по усвоению нового материала на практике. | И/Г Самостоятельная работа Задачи. Упр 1,2 стр 160 1). С1=0.3моль/л С2=0.15моль/л v=С1-С2/t v=0.3-0.15/30суток=0.005моль/л·сутки или v=0.3-0.15/720часов=0.0002моль/л·час. | ФО/ Обратная связь учителя. Похвала. К/О/. экспериментально изучают влияние различных факторов на смещение равновесия 4 баллов | Учебник химии 10 класс, §39. Слайдовая презентация к уроку, этапы урока. | ||||||||||||||||||
| Абдразак Б | ПО/ «Толстые вопросы» Организует индивидуальную работу.
веществ увеличится тоже в 2 раза и скорость реакции станет равна: υпрям2= k×[2H2] ×[2Cl2] υпрям2/ υпрям1= k×[2H2] ×[2Cl2]/k×[H2] ×[Cl2] = 4, υпрям возрастает в 4 раза. 2. Fe2O3 (т) + 3CO (г) = 2Fe (т) + 3CO2 (г) 3 моля СО2 образуется, если в реакцию вступают 3 моля СО, 2 молей СО2 — х х = 2 моль, ⇒ исходная концентрация [CO]исх = [CO]pавн + 2 моль = 1 + 2 = 3 моль. 3. Воспользуемся правилом Вант-Гоффа 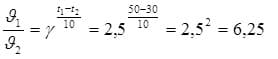 Скорость реакции уменьшится в 6,25 раз 4. К = 4; исходная концентрация HBr составляет 1,5 моль/л. | Изучить §39. Задача 1. Дайте определение понятию скорость химической реакции. Опишите количественно (где это можно), как влияют на скорость реакции внешние условия (концентрация, температура, давление). Рассчитайте, во сколько раз изменится скорость реакции Н2+С12 = 2НС1 при увеличении давления в 2 раза; Задача 2. При установлении равновесия Fe2O3 (т) + 3CO (г) = 2Fe (т) + 3CO2 (г) концентрация [CO] = 1 моль/л и [CO2] = 2 моль/л. Вычислите исходную концентрацию [CO]исх, если начальная концентрация CO2 равна нулю. Задача 3.Температурный коэффициент реакции равен 2,5. Как изменится ее скорость при охлаждении реакционной смеси от изменения температуры от 50 °С до 30 °С? 4. При некоторой температуре равновесные концентрации в системе: 2HBr (г) →H2 (г) + Br2 (г) составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr. | ФО/ Обратная связь учителя. Похвала. К/О/. ПО – 1 балл. 8 балла – за формулу, решение. Рефлексия – 1 балл. | Учебник химии 10 класс, §39. Слайдовая презентация к уроку, этапы урока. | ||||||||||||||||||
| 1 минуты | Физминутка | |||||||||||||||||||||
| Рефлексия 5 минут | Организует проведение рефлексии, комментирует результат работы учеников. «Я узнал, я могу, я применю в жизни» | Рефлексируют, озвучивают . | - Назвать лидеров урока. Салют хлопков. - Назвать лидера группу. Салют хлопков. - Учитель комментирует результат работы учеников. | Слайдовая презентация к уроку, задания. | ||||||||||||||||||
| Домашнее задание | §39 пересказ, учить. | |||||||||||||||||||||
| Дифференциация | Оценивание Охрана здоровья и соблюдение техники безопасности | |||||||||||||||||||||
| | | |||||||||||||||||||||
| Рефлексия по уроку | Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки | |||||||||||||||||||||
| Была ли реальной и доступной цель урока или учебные цели? | | |||||||||||||||||||||
| Все ли учащиеся достигли цели обучения? | | |||||||||||||||||||||
| Если ученики еще не достигли цели, как вы думаете, почему? | | |||||||||||||||||||||
| Правильно проводилась дифференциация на уроке? | | |||||||||||||||||||||
| Эффективно ли использовали вы время во время этапов урока? | | |||||||||||||||||||||
| Были ли отклонения от плана урока, и почему? | | |||||||||||||||||||||
| Общая оценка Две вещи, лучше всего прошедшие на уроке (касающиеся преподавания и обучения)? 1: 2: Что могло бы посодействовать тому, чтобы урок прошел еще лучше? (касающиеся преподавания и обучения)? 1: 2: Что я выяснил на этом уроке о классе или о достижениях/затруднениях отдельных учеников на что обратить внимание на следующем уроке? 1: 2: 3: | | |||||||||||||||||||||
| Вариант 1 | Вариант 2 | ||
| Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции при увеличении температуры на 30 градусов. | При 30 градусах реакция протекает за 3 мин 45 с. За какое время будет протекать эта реакция при повышении температуры до 50 градусов, если температурный коэффициент равен 3? | ||
| Температурный коэффициент реакции равен 2. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 8 раз? | На сколько градусов надо повысить температуру, чтобы скорость реакции возросла в 27 раз. Температурный коэффициент равен 3. | ||
| Температурный коэффициент реакции равен 4. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 16 раз? | При 20 градусах реакция протекает за 5 мин 40 с. За какое время будет протекать эта реакция при повышении температуры до 40 градусов, если температурный коэффициент равен 4? | ||
| Вариант 1 | Вариант 2 | ||
| Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции при увеличении температуры на 30 градусов. | При 30 градусах реакция протекает за 3 мин 45 с. За какое время будет протекать эта реакция при повышении температуры до 50 градусов, если температурный коэффициент равен 3? | ||
| Температурный коэффициент реакции равен 2. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 8 раз? | На сколько градусов надо повысить температуру, чтобы скорость реакции возросла в 27 раз. Температурный коэффициент равен 3. | ||
| Температурный коэффициент реакции равен 4. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 16 раз? | При 20 градусах реакция протекает за 5 мин 40 с. За какое время будет протекать эта реакция при повышении температуры до 40 градусов, если температурный коэффициент равен 4? | ||
| Вариант 1 | Вариант 2 | | |
| Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции при увеличении температуры на 30 градусов. | При 30 градусах реакция протекает за 3 мин 45 с. За какое время будет протекать эта реакция при повышении температуры до 50 градусов, если температурный коэффициент равен 3? | | |
| Температурный коэффициент реакции равен 2. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 8 раз? | На сколько градусов надо повысить температуру, чтобы скорость реакции возросла в 27 раз. Температурный коэффициент равен 3. | | |
| Температурный коэффициент реакции равен 4. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 16 раз? | При 20 градусах реакция протекает за 5 мин 40 с. За какое время будет протекать эта реакция при повышении температуры до 40 градусов, если температурный коэффициент равен 4? | | |
| Вариант 1 | Вариант 2 | | |
| Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции при увеличении температуры на 30 градусов. | При 30 градусах реакция протекает за 3 мин 45 с. За какое время будет протекать эта реакция при повышении температуры до 50 градусов, если температурный коэффициент равен 3? | | |
| Температурный коэффициент реакции равен 2. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 8 раз? | На сколько градусов надо повысить температуру, чтобы скорость реакции возросла в 27 раз. Температурный коэффициент равен 3. | | |
| Температурный коэффициент реакции равен 4. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 16 раз? | При 20 градусах реакция протекает за 5 мин 40 с. За какое время будет протекать эта реакция при повышении температуры до 40 градусов, если температурный коэффициент равен 4? | | |
