ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 7
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение высшего образования
САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ
Кафедра общей химии
Отчёт по лабораторной работе №5
По дисциплине Химия
(наименование учебной дисциплины согласно учебному плану)
Тема работы: Исследование окислительно-восстановительных реакций
Выполнил: студент гр.
(шифр группы) (подпись) (Ф.И.О.)
Дата:
Проверил:
(должность) (подпись) (Ф.И.О)
Санкт-Петербург
2022
Цель работы: Ознакомиться с наиболее распространенными окислителями и восстановителями, с продуктами их взаимодействия, научиться составлять уравнения окислительно-восстановительных реакций.
Основные теоретические сведения
Окислительно-восстановительные реакции – реакции, протекающие с изменением степени окисления элементов.
Степень окисления – это гипотетический заряд, который был бы на атомах данного элемента, если бы соединение было построено из ионов.
Высшая степень окисления элемента равна номеру группы периодической системы, в которой данный элемент расположен. Низшая отрицательная степень окисления равна числу электронов, которое может принять данный элемент на застраивающийся np-подуровень.
Окислитель – элемент, который в ходе реакции понижает степень окисления.
Восстановитель – элемент, который повышает степень окисления.
Окислитель при этом принимает электроны на валентную оболочку, а восстановитель отдает электроны.
Принцип Ле-Шателье: в кислой среде, при избытке ионов Н+, равновесие смещается влево. В щелочной среде, когда ионы Н+ в недостатке, равновесие смещается вправо.
Ход работы
Опыт 1. Окислительные свойства пероксида водорода
H2O2+2KI+H2SO4=I2+K2SO4+2H2O
2K++2I-+H2O2+2H++SO42-=2K++SO42-+I2+2H2O
Восстановление:
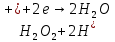
Окисление: 2I-1 = I20 + 2e
2I-+H2O2+2H+=I2+2H2O
Образуется осадок бурого цвета. При добавлении крахмала, раствор окрашивается в синий цвет.
Опыт 2. Восстановительные свойства сульфидов
8KMnO4+12H2SO4+5Na2S=5Na2SO4+8MnSO4+4K2SO4+12H2O
Восстановление:Mn+7+5e=Mn+2
Окисление:S-2-8e=S+6
Раствор малинового цвета, образование белого мутного осадка
Опыт 3. Восстановительные свойства сернистой кислоты
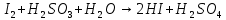
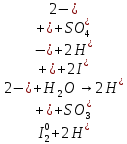
Окисление:
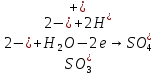
Восстановление:
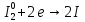
В ходе реакции наблюдаем обесцвечивание раствора
Опыт 4. Окислительные свойства нитритов
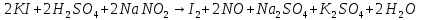
Окисление: 2I-1 = I20 + 2e
Восстановление:
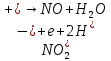
В ходе реакции образовался бурый осадок и наблюдалось бурное выделение газа. После добавления крахмала раствор приобрел синюю окраску.
Опыт 5. Восстановительные свойства нитритов
3H2SO4+2KMnO4
+5NaNO2=5NaNO3+2MnSO4+K2SO4+3H2O
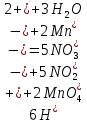
Произошло обесцвечивание раствора
Опыт 6. Окислительные свойства дихромата калия
1) K2Cr2O7+4H2SO4+3Na2SO3=Cr2(SO4)3+K2SO4+3Na2SO4+4H2O
Окисление: S+4-2e=S+6
Восстановление: 2Cr+6+6e=2Cr+3
Наблюдаем темно-зеленое окрашивание раствора
2) K2Cr2O7+7H2SO4+3
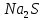 = Cr2(SO4)3+3S+K2SO4+3Na2SO4+7H2O
= Cr2(SO4)3+3S+K2SO4+3Na2SO4+7H2OОкисление:S2--2e=S0
Восстановление: 2Cr+6+6e=2Cr+3
Наблюдаем помутнение раствора
3) K2Cr2O7+7H2SO4+6FeSO4=K2SO4+3Fe(SO4)3+Cr(SO4)3+7H2O
Fe+2-e=Fe+3
2Cr+6+6e=2Cr3+
Интенсивная темная окраска
Качественная реакция с роданидом аммония:
6NH4SCN + Fe2(SO4)3 → 2Fe(SCN)3 + + 3(NH4)2SO4
Опыт 7. Окислительные свойства KMnO4 в различных средах
А. Кислая среда
2KMnO4+10KI+8H2SO4=2MnSO4+6K2SO4+5I2+8H2O
Mn+7+5e=Mn+2
2I--2e=I20
Раствор стал светлее, изменил окраску с бурой на желтую
5Na2SO3+2KMnO4+3H2SO4=2MnSO4+5Na2SO4+K2SO4+3H2O
Mn+7+5e=Mn+2
S+4-2e=S+6
Наблюдаем обесцвечивание раствора
10FeSO4
+2KMnSO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
Mn+7+5e=Mn+2
Fe+2-e=Fe+3
Раствор обесцветился
Б. Нейтральная среда
3Na2SO3+2KMnO4+H2O=3Na2SO4+2MnO2+2KOH
Mn+7+3e=Mn+4
S+4-2e=S+6
Желтоватый цвет раствора, выпадение осадка
3MnSO4+2KMnO4+4H2O=5MnO2+3H2SO4+2KOH
Mn+7+3e=Mn+4
Mn+2-2e=Mn+4
Темно-желтый цвет раствора, выпадение осадка
В. Щелочная среда
6KMnO4+12NaOH+KI=6Na2MnO4+KIO3+6KOH+3H2O
Mn+7+e=Mn+6
Na+-e=Na+2
Раствор зеленого цвета, выпадение осадка
Вывод
В ходе лабораторной работы мной были изучены наиболее распространенные окислители и восстановители, проведены реакции, составлены уравнения окислительно-восстановительных реакций, изучен метод полуреакций.


