ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.02.2024
Просмотров: 13
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
-
Предмет термодинамики. Химическая термодинамика.
Термодинамика – это наука изучающая взаимный переход различных форм энергии. Предметом Т. является термодинамическая система. Химическая термодинамика изучает переходы энергии в химических реакциях. Термодинамика имеет дело только с макроскопическими объектами и нет понятия времени. А изучает только состояние системы.
-
Понятие термодинамической системы. Наиболее общие характеристики системы.
Термодинамическая система- это выбранная часть окружающего мира, имеющая реальные или условные границы, наполненная одним или несколькими веществами. Параметрысистемы: Объем, масса, температура, давление, концентрация компонентов.
-
Классификация термодинамических систем.
Изолированная- система, которая не отлает и не принимает энергию и вещество из окружающей среды. (идеальный термос)
Закрытая – Система которая обменивается энергией, но не обменивается вещество с окружающим миром. (батарея, закрытая колба)
Открытая- обменивается с окружающим миром и веществом, и энергией. (стакан с водой, открытая колба)
-
Дать понятие о состояние системы. Равновесное, неравновесное, стационарное.
Равновесная – система не обменивается с окружающей средой ни веществом, ни энергией и ее параметры не изменяются.
Стационарное – когда система обменивается и веществом, и энергией, и ее параметры не изменяются
Неравновесное - когда параметры изменяются.
-
Системы гомогенные, гетерогенные.
по структуре различают:
- гомогенныесистемы,
в которых структурные элементы распределены равномерно (свойства одинаковы в любой точке)
ПР: плазма крови
- гетерогенныесистемы,
в которых структурные элементы распределены неравномерно и выделяют «фазы» и «границы раздела фаз» вода со льдом, масло и вода.
6. Дайте определение понятию фаза. Примеры однофазной и многофазной системы.
Фаза – это та часть системы, в которой все ее элементы однородны в любой точке. Однофазные системы те, которые полностью однородны, например, вода, графит, пар. Многофазная система — это система которая содержит несколько фаз, и имеет границу раздела фаз. Например, вода и масло, вода и лёд, вода и камень. Переход из одной фазы в другую сопровождается выделением энергии.
7. Дайте определение функция системы. Примеры основных функций
Это энергетические параметры, которые зависят от параметров системы, и не зависят от способа достижения состояния.
Внутренняяэнергия–Е (U-в методичке). Складывается из кинетической энергии движения частиц в системе. из потенциальной энергии между частицами. И потенциальной движения химических связей. (в методички из Теплоты минус работа.). Е=Е2-Е1
Энтальпия - Н. Разница энтальпий является тепловой эффект. Складывается из внутренней энергии и работы (давление на разницу объемов).
Энтропия–S. Состоит из теплоты, деленной на температуру.
И энергияГиббса - G. Состоит из Энтальпия минус Энтропия, умноженная на температуру.
8. Полная энергия системы
Это энергия движения частицы как целого. Складывается из Потенциальной (выстрел и притяжение к земле патроны) - обусловлено положением системы в каком-либо внешнем месте. И из Внутренней (атомы молекулы самой патроны) – которой обладают атомы и молекулы самой системы, и освобождающиеся при физической или химической процессах.
9. Внутренняя энергия системы.
Внутренняяэнергия–Е (U-в методичке). Складывается из
-кинетической энергии движения частиц в системе.
-из потенциальной энергии между частицами.
-И потенциальной- движения химических связей.
(в методички из Теплоты минус работа.). Е=Е2-Е1 единицы размерности: ккал/мол; Дж/моль.
Можно определить только изменение внутренней энергии.
10.Формы обмена энергии между системами.
Работа–упорядоченная форма передачи энергии, сопровождающаяся переносом частиц в определенном направление (работа расширения). A=p∆V p-внешние давление
Теплообмен- неупорядоченная форма передачи энергии. Происходит в результате хаотичного движения молекул и не сопровождается переносом вещества.
11. Работа. Определение и математическое выражение.
Работа–упорядоченная форма передачи энергии, сопровождающаяся переносом частиц в определенном направление (работа расширения). A=p∆V p-внешние давление
12. Термодинамические процессы. Самопроизвольные и не самопроизвольные
обратимые и не обратимые.
Для закрытых и открытых систем. Самопроизвольный процесс идет без воздействия внешних сил. Как правило произвольность процесса можно вычислить, зная энергию Гиббса. Если энергия меньше 0, то реакция может идти самопроизвольно. Для изолированных систем нужно знать энтропию S. Если она больше нуля, то может идти самопроизвольно. При нуле она обратима.
Обратимая– в которой может происходить явление возникновения обратного превращения масс вещества и обратного изменения внутренней энергии без ее потери во внешнюю среду.
Необратимость- это невозможность после реакции получить исходные продукты реакции без дополнительных затрат. Все процессы в организме не обратимые так как идет обмен с окружающей средой.
13.14. Изохорные.Изобарные.Изотерм процессы. Тепловой эффект изохорных и изобарных процессов.
Изохорный – объем постоянен. Q = U+ A; A=p∆V; V=0; p∆V=0; Q=∆U; Визохорном процессе тепловой эффект будет зависеть от разности внутренней энергии системы.
Изобарный – постоянно давление. Тепловой эффект зависит от энтальпии. Q = U + A = U2- U1+ рV = U2- U1+ рV2- рV1 = (U2+ рV2)- (U1+ рV1) = Н2- Н1= Н
Изотермический – температура постоянна. Зависимость давления от объема при постоянной температуре будет равно константа.
Адиабатический процесс, происходящий без обмена энергии с окружающей средой. Q=0
15. первый закон термодинамики/ 16. термохимические уравнения их особенности примеры
Разные формы энергии ни исчезают и не возникают из ничего, а лишь переходят из одной формы в другую в эквивалентных соотношениях.
Для изолированной системы общий запас внутренней системы постоянен ∆U=0
Для закрытых систем энергия, полученная системой в форме теплоты, расходится на увеличение внутренней энергии и на работу.Q=∆E+A
Особенности таких уравнений в том, что они содержат информацию о агрегатном состояние вещества, тепловой эффект реакции.
17.18. Энтальпия.
Энтальпия - Н. это функция состояния системы, увеличение которой равна теплоте полученной системы при изобарном процессе. Разница энтальпий является тепловой эффект. Складывается из внутренней энергии и работы (давление на разницу объемов).
при изобарном процессе система совершает работу расширения A = р V,
поэтому Q = U + A = U2- U1+ р V = U2- U1+ р V2- р V1 = (U2+ р V2)- (U1+ р V1) = Н2- Н1= Н
выражение Н = U + р V есть энтальпия
Стандартная энтальпия образования ∆Н298
Энтальпия образования в стандартных условиях простого вещества равна нулю = 0.
Энтальпия образования сложного вещества в стандартных условиях равна энтальпии реакции образования его из простых веществ обращенный к 1 молю вещества.
19. Закон Гесса
Суммарный тепловой эффект системы не зависит от промежуточных состояний системы и путей переходов, а лишь от начального и конечного состояния системы.
ПР: последовательная реакция 2С(т)+ О2(г) 2СО(г); 2СО + О2 2СО2 и простая реакция С + О2 СО2
ПР: реакции нейтрализации имеют один тепловой эффект для всех кислот и оснований (реакция Н++ ОН- Н2О)
20. Следствия законов Гесса
1) Тепловой эффект равен разности сумм теплот образования продуктов реакции и сумм теплот образования исходных веществ. ∆Н=∑Нпрод.обр.-∑Нисход.обр
2) Тепловой эффект равен разности сумм теплот сгорания исходных веществ и сумм теплот сгорания продуктов реакции. ∆Н=∑Нисход.сгор. -∑Нпрдуктов.сгор.
3) Тепловой эффект вещества равен тепловому эффекту разложения с обратным знаком. ∆Нобраз=--∆Нразлож
4) Если протекает 2 реакции которые имеют одинаковые исходные вещества, но различные конечные продукты. То разница этих тепловых эффектов реакций будет равна тепловому эффекту перехода одного конечного вещества в другое.
5) различие энтальпий двух хим. реакций с разными конечными в-вами и одинаковыми исходными в-вами
есть энтальпия перехода одних конечных в-в другие
21. Окисление БЖУ ккал и Дж
| | ККАЛ/Г | КДЖ/Г |
| Углеводы | 4 | 16,8 |
| Белки | 4 | 16,8 |
| Жиры | 9 | 38,9 |
22. Применение первого закона термодинамики для живых систем
1) Живой организм является открытой системой
- Энергия с– термодинамические процессы в живых организмах необратимые, многоступенчатые-последовательные
-когда параметры системы не меняются, система находится в равновесии,
-но равновесие динамическое - есть приток энергии и приток расходуемых исходных в-в потери энергии(теплоты) и удаление продуктов обмена в-в,
на поддержание равновесия(гомеостаза) расходуется энергия Гиббса («свободная энергия») системы
- приток энергии обеспечен притоком питательных в-в, которые подвергаются окислению
часть энергии, выделяемой при окислении питательных в-в, превращается в энергию хим. Связей ПР: АТФ
- живые организмы совершают работу, расходуя энергию Гиббса («свободную энергию»)
виды работы в живом организме – активный транспорт в-в ч/з клеточную мембрану, сокращение мышц, синтез белков.
- энтропия живых организмов не максимальная (максимальная энтропия у мертвых организмов)
23.термодинамичское определение энтропии
Энтропия – это функциональная характеристика системы, которая говорит о мере хауса т.е. о той энергии которая не может быть включена в упорядоченную работу при данной температуре. Энтропия — это количество приращенного тепла (т.е. получено-отданного тепла) относящиеся к температуре данной системы.
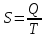 Энтропия – это мера связанной энергии, не вступающей в работу.
Энтропия – это мера связанной энергии, не вступающей в работу. 24. Молекулярно- кинетическое определение энтропии. Уравнение Больцмана.
Система стремится в самопроизвольных процессах к неупорядоченному состоянию. (т.о. энтропия есть мера вероятности пребывания системы в не упорядоченном состояние).
Уравнение Больцмана: S=KlnW (S – абсолютное значение энтропии. K=R/Na=1.38*10-23 Дж- константа Больцмана W – число микросостояний) уравнение показывает чем больше включено микросостояний в систему тем выше энтропия.
25. 26, Изменение энтропии в процессах полимеризации и дезагрегации. И в общее ее изменение.
Сумма энтропии мономеров больше чем у суммы полимеров. Так как при увеличении числа микросистем энтропия возрастает. Например, при употреблении в пищу белков, ни распадаются на мономеры во время переваривания и энтропия возрастает.


