Файл: Отчет по лабораторной работе 6 По дисциплине Общая химия Тема работы Исследование окислительновосстановительных реакций Выполнила студентка гр.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 10
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ

ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ
КАФЕДРА ОБЩЕЙ ХИМИИ
Отчет по лабораторной работе № 6
По дисциплине: Общая химия
Тема работы: Исследование окислительно-восстановительных реакций
Выполнила студентка гр. __________ / /
(подпись) (Ф.И.О.)
Проверил ___________ ______________
(подпись) (Ф.И.О.)
ОЦЕНКА: ____________
Дата: ________________
Санкт-Петербург
2022
Общие теоретические сведения
Окислительно-восстановительными называют реакции, протекающие с изменением степени окисления элементов.
Степень окисления – это гипотетический заряд, который был бы на атомах данного элемента, если бы соединение было построено из ионов.
Высшая степень окисления элемента равна номеру группы Периодической системы, в которой данный элемент расположен. Низшая степень окисления равна числу электронов, которое может принять данный элемент на застраивающейся np-подуровень: zmin=N-8, где N – номер группы. В простых веществах степень окисления равна нулю. Многие элементы проявляют в соединениях постоянные значения степени окисления:
-
Фтор –1 -
Кислород –2, кроме перекиси и пероксидов, где степень окисления кислорода –1 -
Щелочные металлы +1 -
Щелочно-земельные металлы +2
-
Водород кроме гидридов и органических соединений, +1
Степени окисления переменно-валентных элементов рассчитывают по правилу баланса зарядов: «Сумма степеней окисления всех элементов в соединения равна нулю, а в многоатомном ионе-заряду иона»
Окислителем называют элемент, который в ходе реакции понижает степень окисления, а восстановителем – элемент, который повышает степень окисления.Окислитель при этом принимает электроны на валентную оболочку. А восстановитель отдает электроны.
Цель: ознакомиться с наиболее распространенными
окислителями и восстановителями, с продуктами их взаимодействий между собой и научиться составлять уравнения окислительно-восстановительных реакций.
Порядок выполнения работы
Опыт 1. Окислительные свойства пероксида водорода
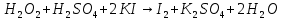 (черный осадок)
(черный осадок)2
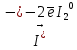 1 Восстановитель, окисление
1 Восстановитель, окисление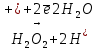 1 Окислитель, восстановление
1 Окислитель, восстановление2
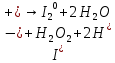
Опыт 3. Восстановительные свойства сульфидов
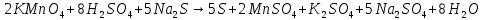
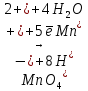 2 Окислитель, восстановление
2 Окислитель, восстановление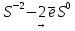 5 Восстановитель, окисление
5 Восстановитель, окисление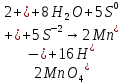
Опыт 6. Окислительные свойства нитритов
2NaNO2 + 2KI + 2H2SO4
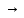 I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
I2 + 2NO + K2SO4 + Na2SO4 + 2H2O 2
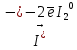 1 Восстановитель, окисление
1 Восстановитель, окислениеN+3 +
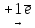 N+22 Окислитель, восстановление
N+22 Окислитель, восстановлениеОпыт 7. Восстановительные свойства нитритов
5NaNO2 + 2KMnO4 + 3H2SO4
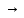 5NaNO3 + 2MnSO4 + H2SO4 + 3H2O
5NaNO3 + 2MnSO4 + H2SO4 + 3H2O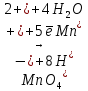 2 Окислитель, восстановление
2 Окислитель, восстановлениеNO2-
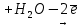 NO3- +
NO3- + 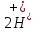 5 Восстановитель, окисление
5 Восстановитель, окисление2
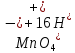 + 5NO2-
+ 5NO2-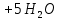
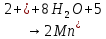 NO3- +
NO3- + 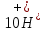
Опыт 8. Окислительные свойства дихромата калия
1)
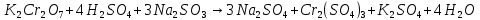 (зеленый раствор)
(зеленый раствор)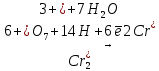 1 Окислитель, восстановление
1 Окислитель, восстановление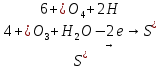 3 Восстановитель, окисление
3 Восстановитель, окисление2)
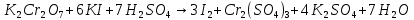
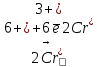
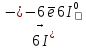
3)
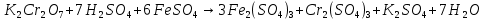
(ярко-желтый раствор)
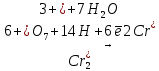 1 Окислитель, восстановление
1 Окислитель, восстановление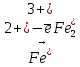 6 Восстановитель, окисление
6 Восстановитель, окислениеОпыт 9.
a)
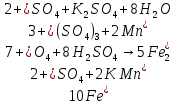
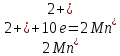 1 Окислитель, восстановление
1 Окислитель, восстановление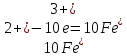 1 Восстановитель, окисление
1 Восстановитель, окислениеб) 1)
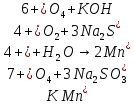
(желтый раствор с коричневым осадком)
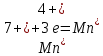 2 Окислитель, восстановление
2 Окислитель, восстановление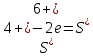 3 Восстановитель, окисление
3 Восстановитель, окисление2)
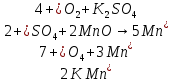
(раствор коричневого цвета)
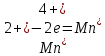 3 Окислитель, восстановление
3 Окислитель, восстановление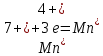 2 Восстановитель, окисление
2 Восстановитель, окислениеВывод: ознакомился с наиболее распространенными окислителями и восстановителями, с продуктами их взаимодействий между собой и научился составлять уравнения окислительно-восстановительных реакций.


