Файл: Расчеты рН для кислот, оснований и солей. Буферные растворы.docx
Добавлен: 15.03.2024
Просмотров: 66
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Федеральное государственное автономное образовательное учреждение высшего образования «Уральский Федеральный университет имени первого Президента России Б.Н.Ельцина»
Химико-технологический институт
Кафедра «Аналитической химии»
РЕФЕРАТ
Тема: Расчеты рН для кислот, оснований и солей. Буферные растворы
Выполнил:
студент группы Х-210007
Сергеев Антон Алексеевич
Проверила:
доктор химических наук,
заведующая кафедрой аналитической химии
Козицина Алиса Николаевна
Екатеринбург, 2022
Содержание
ВВЕДЕНИЕ 3
РАСЧЕТ PH ВОДНЫХ РАСТВОРОВ 4
Расчет pH сильной кислоты и сильного основания 4
Расчет pH слабой кислоты и слабого основания 4
Расчет pH солей 6
1)Соль образована сильным основанием и сильной кислотой 6
2)Соль образована сильным основанием и слабой кислотой 6
3)Соль образована слабым основанием и сильной кислотой 7
4)Соль образована слабой основанием и слабой кислотой 8
БУФЕРНЫЕ РАСТВОРЫ 9
Расчет pH буферных растворов 9
Свойства буферных растворов 11
Буферная ёмкость 11
ВЫВОД 16
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА 17
3.Васильев В.П. Аналитическая химия. В 2 кн. Кн. 1. Титриметрические и гравиметрические методы анализа: Учеб. Для студ. вузов, обучающихся по химико-технол. спец. – 2-е изд., прераб. и доп. – М.: Дрофа, 2002. – 368 с.: ил. 17
ВВЕДЕНИЕ
Водородный показатель (pH произносится «пэ-аш») — мера определения кислотности водных растворов. Ассоциирована с концентрацией ионов водорода, что эквивалентно активности ионов водорода в сильно разбавленных растворах.
Для водных растворов (при стандартных условиях) водородный показатель составляет:
-
pH < 7 соответствует кислотному раствору; -
pH = 7 соответствует нейтральному раствору; -
pH > 7 соответствует щелочному раствору.
Водородный показатель может быть определён с помощью кислотно-основных индикаторов, измерен потенциометрическим pH-метром или вычислен по формуле как величина, противоположная по знаку и равная по модулю десятичному логарифму активности водородных ионов, выраженной в молях на литр:

pH = -lg [H+]
{\displaystyle {\mbox{pH}}=-\lg \left[{\mbox{H}}^{+}\right]}

РАСЧЕТ PH ВОДНЫХ РАСТВОРОВ
Расчет pH сильной кислоты и сильного основания
Протолитическое равновесие
HA + H2O = H3O+ + A-
B + H2O = BH+ + OH-
смещено полностью вправо. Равновесие автопротолиза при Cк-ты 10-6 моль/л или Cосн 10-6 моль/л подавлено, поэтому
[H+] = Cк-ты pH = -lg [H+] = -lg Cк-ты
[OH-] = Cосн pOH = -lg [OH-] = -lg Cосн
Учитывая, что [H+][OH-] = KW, получаем
[H+] =
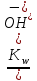 , pH = pKw – lg Cосн = 14 - lg Cосн
, pH = pKw – lg Cосн = 14 - lg CоснЕсли Cк-ты 10-6 моль/л или Cосн 10-6 моль/л, надо необходимо учитывать ионы водорода, которые образуются при автопротолизе воды. В этом случае общее количество ионов H+ в растворе кислоты складывается из ионов, которые получились при диссоциации воды и автопротолизе воды. Концентрация последних равна [OH-]-:
[H+] = Cк-ты + [OH-] =
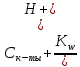
тогда
[H+]2 - Cк-ты*[H+] + Kw = 0
[H+] =
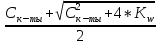
Расчет pH слабой кислоты и слабого основания
В растворе слабой кислоты устанавливается равновесие
HA + H2O
Если кислота диссоциирована мало ( 5%), можно считать, что Cк-ты = [HA]. Если ионов водорода, образовавшихся при диссоциации HA, достаточно для подавления автопротолиза воды, то можно считать единственным источником их появления и полагать, что [H+] = [A-]. С учетом этих допущений получим
Ka =
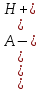 =
= 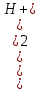
тогда
[H+] =
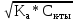
pH =
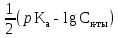
Источником гидроксил-ионов в растворе слабого основания является равновесие
B + H2O
Степень диссоциации основания достаточно мала, получаем:
[OH-] =
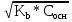
или
[H+] =
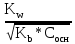 pH = pKw –
pH = pKw – 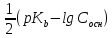
Пусть допущения, сделанные при выводе формул, неправомерные. При 5% имеем [HA] Cк-ты, [HA] = Cк-ты - [H+], тогда
Ka =
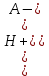 =
= 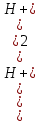
После несложных преобразований получим уравнение
[H+]2 + Ka[H+] - Cк-ты Ka
Решая его, получим
[H+] =
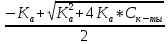
Аналогично, для основания при 5% получим
[H+] =
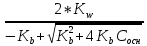
Если Cк-ты 10-4 моль/л, Ka 10-8 , то необходимо учитывать поступление ионов H+ или OH- за счет автопротолиза. Применяя уравнение электронейтральности
[H+] = [A-] + [OH-],
получаем
[H+] =
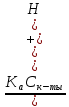 +
+ 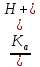 , [H+] =
, [H+] = 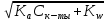
Расчет pH солей
Расчет pH солей производят исходя из уравнения гидролиза соответствующих солей
-
Соль образована сильным основанием и сильной кислотой
Соль, которая образована сильным основанием (щелочью) и сильной кислотой (например, NaCl, K2SO4), не подвергается гидролизу. Водные растворы таких солей имеют нейтральную среду. pH таких солей равен 7.
-
Соль образована сильным основанием и слабой кислотой
Если соль образована слабой кислотой и сильным основанием. Например, ацетат натрия CH3COONa, то уравнение гидролиза запишется так
CH3COONa + H2O
CH3COO- + H2O
Константа гидролиза уравнения будет равна:
Kг =
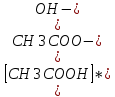 =
= 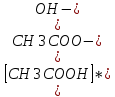 *
* 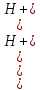
=
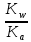
Степень гидролиза будет равна
h =
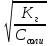 =
= 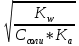
Концентрация ионов OH- будет равно
[OH-] = hСсоли = Ссоли *
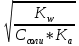 =
= 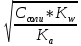
pOH = - lg [OH-] = - lg (
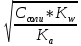 ) = 7 -
) = 7 - 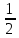 *lg Cсоли -
*lg Cсоли - 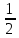 *pKa
*pKapH = 14 – pOH = 14 – 7 +
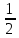 *lg Cсоли +
*lg Cсоли + 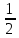 *pKa = 7 +
*pKa = 7 + 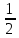 *lg Cсоли +
*lg Cсоли + 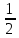 *pKa
*pKaВ итоге pH соли сильного основания и слабой кислоты можно находить по формуле:
pH = 7 +
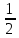 *lg Cсоли +
*lg Cсоли + 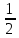 *pKa
*pKa-
Соль образована слабым основанием и сильной кислотой
Если соль образована сильной кислотой и слабым основанием. Например, хлорид аммония NH4Cl, то уравнение гидролиза запишется так
NH4Cl + H2O
NH4+ + H2O
Константа гидролиза реакции будет равна
Kг =
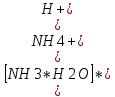 =
= 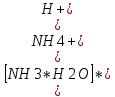 *
* 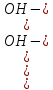 =
= 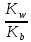
Степень гидролиза будет равна
h =
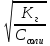 =
= 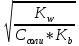
Концентрация ионов H+ будет равна
[H+] = hСсоли = Ссоли *
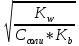
=
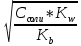
pH = - lg [H+] = - lg (
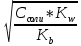 ) = 7 +
) = 7 + 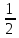 *lg Cсоли +
*lg Cсоли + 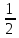 *pKb
*pKbВ итоге pH соли слабого основания и сильной кислоты можно находить по формуле:
pH = 7 +
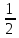 *lg Cсоли +
*lg Cсоли + 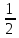 *pKb
*pKb-
Соль образована слабой основанием и слабой кислотой
Если соль образована слабой кислотой и слабым основанием. Например, ацетат аммония CH3COONH4, то гидролиз
CH3COONH4 + H2O
протекает практически полностью. Константа гидролиза рассчитывается
Kг =
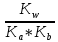
pH такого раствора зависит только от величин констант диссоциации кислоты и основания и не зависит от концентрации соли:
pH =
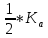 +
+ 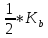
БУФЕРНЫЕ РАСТВОРЫ
Буферные растворы — это растворы, рН которых меняется незначительно при разбавлении или при добавлении небольших количеств кислоты или щелочи
Буферные растворы могут быть:
-
Кислотно-основными — поддерживают постоянное значение рН при введении кислот или оснований; -
Окислительно-восстановительными — сохраняют постоянным потенциал системы при введении окислителей или восстановителей; -
Металлобуферными — поддерживают постоянное значение концентрации ионов металла.
Буферный раствор представляет собой сопряженную пару; в частности, кислотно-основный буферный раствор — сопряженную кислотно-основную пару. Например, ацетатный буферный раствор состоит из CH3COOH и CH3COONa, аммиачный — из NH3 и NH4Cl, фосфатный — из NaH2PO4 и Na2HPO4.
Расчет pH буферных растворов
В растворе, который содержит сопряженную кислотно-основную пару, устанавливается два равновесия:
HA + H2O
