Файл: Расчеты рН для кислот, оснований и солей. Буферные растворы.docx
Добавлен: 15.03.2024
Просмотров: 70
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
H3O+ + A-
A- + H2O HA + OH-
HA + OH-
Оба равновесия сильно сдвинуты влево, поскольку в растворе находятся достаточные количества как кислоты НА, так и основания A−. Константа первого равновесия является константой кислотности НА:
Ka =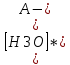
отсюда
[H3O-] = Kа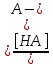
Поскольку равновесия сдвинуты влево, в первом приближении можно считать, что [HA] ≈ Cк-ты, [A-] ≈ Сосн, поэтому
[H3O-] = Kа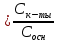 , pH = pKa + lg
, pH = pKa + lg 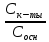
К этому же выражению мы пришли бы исходя из второго равновесия. Заметим, что уравнение не меняется, если кислота заряжена, а сопряженное основание — нет, или если оба компонента несут заряд. В общем случае имеем
pH = pKa + lg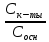
При выводе уравнения (5.15) не учитываем ионы водорода, образовавшиеся в результате диссоциации воды, полагая, что автопротолиз подавлен в присутствии частиц НА и А-.
Однако если кислота или основание диссоциированы в заметной степени, сделанные допущения могут оказаться неправомерными. В этом случае имеем Ск-ты ≠ [HA], [HA] = Ск-ты − [H+]; Сосн ≠ [A-], [A-] = Сосн − [OH-], а если учесть автопротолиз воды, то получим
[HA] = Cк-ты – [H+] + [OH-]
[A-] = Cосн – [OH-] + [H+]
Тогда в буферном растворе
[H+] = Kа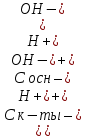
Значение рН буферного раствора остается неизменным при разбавлении, поскольку отношение Ск-ты/Cосн не меняется. И лишь при очень большом (в 104 раз и более) разбавлении следует учесть автопротолиз воды: значение рН при этом может измениться на 0,5–1,0 единиц рН. При точных расчетах или при точном измерении рН следует учитывать изменения коэффициентов активности кислоты и основания, а они изменяются по-разному для заряженных и незаряженных электролитов.
Буферные растворы мало изменяют рН при добавлении кислоты или основания. Действительно, при добавлении к раствору, содержащему частицы НА и А-, сильной кислоты ионы лиония (в воде это ионы гидроксония) взаимодействуют с основанием А-, образуя кислоту НА. При этом суммарная концентрация частиц А- и НА сохраняется; меняется соотношение [НА]/[А-], но логарифм этого отношения изменяется мало. Аналогично, при добавлении к буферному раствору сильного основания ионы лиата (в воде это ионы ОН-) реагируют с кислотой НА, образуя основание А-. Соотношение концентраций компонентов меняется, но на значении рН это мало сказывается
Очевидно, что добавлять сильную кислоту или сильное основание к буферному раствору и надеяться на несущественное изменение рН можно лишь в определенных пределах. Каждый буферный раствор характеризуется сопротивляемостью к изменениям, количественно ее выражают буферной емкостью
Буферная емкость π определяется числом молей сильной кислоты или сильного основания, которое нужно добавить к 1 л раствора, чтобы изменить рН раствора на единицу:
=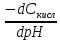 , =
, = 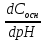 ,
,
где dСкисл, dСосн — прирост концентрации соответственно сильной кислоты и сильного основания, вызвавший изменение на dрН (знак «минус» указывает на уменьшение рН при добавлении сильной кислоты НА)
Бесконечно малый прирост концентрации сильной кислоты dСк-ты вызывает такой же прирост концентрации слабой кислоты d[HA], а бесконечно малый прирост концентрации сильного основания dСосн приводит к появлению такого же количества слабого основания d[A-], только в первом случае рН немного уменьшится, а во втором — увеличится. Суммарная концентрация компонентов буферного раствора Сбуф не меняется (уравнение материального баланса):
Сбуф = [НА] + [А-]
Учитывая, что pH = −lg[H+], получаем
=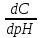 =
= 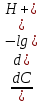 = -2,3 *
= -2,3 * 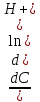 = -2,3 *
= -2,3 * 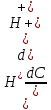 (*)
(*)
Буферная емкость зависит от концентрации компонентов буферного раствора. Из выражения для константы диссоциации кислоты НА находим
[H+] = Kа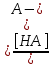
Из уравнения материального баланса получаем
[HA] = Сбуф − [А-],
следовательно,
[H+] = Kа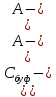 = Kа
= Kа 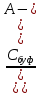
Дифференцируя по [А-], находим
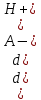 = - Kа
= - Kа 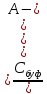
Подставляя полученные выражения в уравнение (*), имеем
= -2,3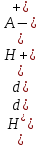 = -2,3Kа
= -2,3Kа 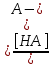 (
(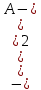 ) = 2,3
) = 2,3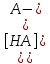 = 2,3*
= 2,3*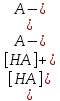
Таким образом, окончательно получим
= 2,3*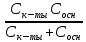
Буферную емкость можно связать с другим параметром системы — константой диссоциации Kа. Используем константу диссоциации кислоты НА и уравнение материального баланса:
Ка =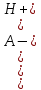 =
= 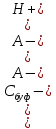
отсюда
[A-] =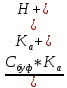
При добавлении dСосн сильного основания образуется d[А−] основания А−, поэтому
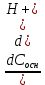 =
= 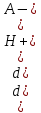 = -
= - 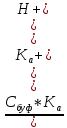
= 2,3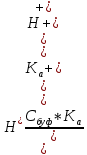
Зная буферную емкость, можно найти изменение рН раствора при добавлении сильной кислоты или сильного основания, определить состав буферной смеси.
Буферная емкость зависит от суммарной концентрации компонентов и соотношения их концентраций. Из последнего уравнения видно, что чем больше Сбуф, тем больше буферная емкость. Максимальное значение π имеет при равенстве концентраций компонентов сопряженной пары
Исходя из вышеизложенного, можно сделать вывод, что для расчета значений водородного показателя pH необходимо знать значения концентраций различных соединений: кислот, солей и оснований, также нам для расчета pH солей необходимо знать значения констант диссоциаций кислот и оснований, которыми образованы эти соли
Также мы узнали про буферные растворы, вывели формулу, по которой можно рассчитать pH таких раствором, также мы узнали про свойства буферных растворов и узнали про буферные ёмкости
A- + H2O
Оба равновесия сильно сдвинуты влево, поскольку в растворе находятся достаточные количества как кислоты НА, так и основания A−. Константа первого равновесия является константой кислотности НА:
Ka =
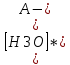
отсюда
[H3O-] = Kа
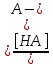
Поскольку равновесия сдвинуты влево, в первом приближении можно считать, что [HA] ≈ Cк-ты, [A-] ≈ Сосн, поэтому
[H3O-] = Kа
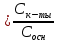 , pH = pKa + lg
, pH = pKa + lg 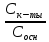
К этому же выражению мы пришли бы исходя из второго равновесия. Заметим, что уравнение не меняется, если кислота заряжена, а сопряженное основание — нет, или если оба компонента несут заряд. В общем случае имеем
pH = pKa + lg
При выводе уравнения (5.15) не учитываем ионы водорода, образовавшиеся в результате диссоциации воды, полагая, что автопротолиз подавлен в присутствии частиц НА и А-.
Однако если кислота или основание диссоциированы в заметной степени, сделанные допущения могут оказаться неправомерными. В этом случае имеем Ск-ты ≠ [HA], [HA] = Ск-ты − [H+]; Сосн ≠ [A-], [A-] = Сосн − [OH-], а если учесть автопротолиз воды, то получим
[HA] = Cк-ты – [H+] + [OH-]
[A-] = Cосн – [OH-] + [H+]
Тогда в буферном растворе
[H+] = Kа
Свойства буферных растворов
Значение рН буферного раствора остается неизменным при разбавлении, поскольку отношение Ск-ты/Cосн не меняется. И лишь при очень большом (в 104 раз и более) разбавлении следует учесть автопротолиз воды: значение рН при этом может измениться на 0,5–1,0 единиц рН. При точных расчетах или при точном измерении рН следует учитывать изменения коэффициентов активности кислоты и основания, а они изменяются по-разному для заряженных и незаряженных электролитов.
Буферные растворы мало изменяют рН при добавлении кислоты или основания. Действительно, при добавлении к раствору, содержащему частицы НА и А-, сильной кислоты ионы лиония (в воде это ионы гидроксония) взаимодействуют с основанием А-, образуя кислоту НА. При этом суммарная концентрация частиц А- и НА сохраняется; меняется соотношение [НА]/[А-], но логарифм этого отношения изменяется мало. Аналогично, при добавлении к буферному раствору сильного основания ионы лиата (в воде это ионы ОН-) реагируют с кислотой НА, образуя основание А-. Соотношение концентраций компонентов меняется, но на значении рН это мало сказывается
Буферная ёмкость
Очевидно, что добавлять сильную кислоту или сильное основание к буферному раствору и надеяться на несущественное изменение рН можно лишь в определенных пределах. Каждый буферный раствор характеризуется сопротивляемостью к изменениям, количественно ее выражают буферной емкостью
Буферная емкость π определяется числом молей сильной кислоты или сильного основания, которое нужно добавить к 1 л раствора, чтобы изменить рН раствора на единицу:
=
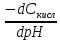 , =
, = 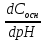 ,
,где dСкисл, dСосн — прирост концентрации соответственно сильной кислоты и сильного основания, вызвавший изменение на dрН (знак «минус» указывает на уменьшение рН при добавлении сильной кислоты НА)
Бесконечно малый прирост концентрации сильной кислоты dСк-ты вызывает такой же прирост концентрации слабой кислоты d[HA], а бесконечно малый прирост концентрации сильного основания dСосн приводит к появлению такого же количества слабого основания d[A-], только в первом случае рН немного уменьшится, а во втором — увеличится. Суммарная концентрация компонентов буферного раствора Сбуф не меняется (уравнение материального баланса):
Сбуф = [НА] + [А-]
Учитывая, что pH = −lg[H+], получаем
=
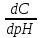 =
= 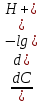 = -2,3 *
= -2,3 * 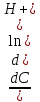 = -2,3 *
= -2,3 * 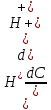 (*)
(*)Буферная емкость зависит от концентрации компонентов буферного раствора. Из выражения для константы диссоциации кислоты НА находим
[H+] = Kа
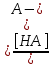
Из уравнения материального баланса получаем
[HA] = Сбуф − [А-],
следовательно,
[H+] = Kа
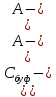 = Kа
= Kа 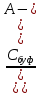
Дифференцируя по [А-], находим
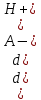 = - Kа
= - Kа 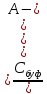
Подставляя полученные выражения в уравнение (*), имеем
= -2,3
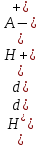 = -2,3Kа
= -2,3Kа 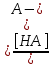 (
(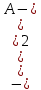 ) = 2,3
) = 2,3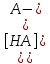 = 2,3*
= 2,3*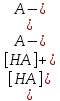
Таким образом, окончательно получим
= 2,3*
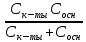
Буферную емкость можно связать с другим параметром системы — константой диссоциации Kа. Используем константу диссоциации кислоты НА и уравнение материального баланса:
Ка =
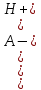 =
= 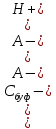
отсюда
[A-] =
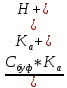
При добавлении dСосн сильного основания образуется d[А−] основания А−, поэтому
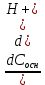 =
= 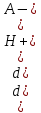 = -
= - 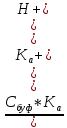
= 2,3
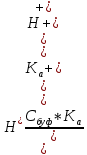
Зная буферную емкость, можно найти изменение рН раствора при добавлении сильной кислоты или сильного основания, определить состав буферной смеси.
Буферная емкость зависит от суммарной концентрации компонентов и соотношения их концентраций. Из последнего уравнения видно, что чем больше Сбуф, тем больше буферная емкость. Максимальное значение π имеет при равенстве концентраций компонентов сопряженной пары
ВЫВОД
Исходя из вышеизложенного, можно сделать вывод, что для расчета значений водородного показателя pH необходимо знать значения концентраций различных соединений: кислот, солей и оснований, также нам для расчета pH солей необходимо знать значения констант диссоциаций кислот и оснований, которыми образованы эти соли
Также мы узнали про буферные растворы, вывели формулу, по которой можно рассчитать pH таких раствором, также мы узнали про свойства буферных растворов и узнали про буферные ёмкости
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
-
Основы аналитической химии. В 2 т. Т. 1 : учеб. для студ. учреждений высш. проф. образования / [Т.А.Большова и др.] ; под ред. Ю.А.Золотова. — 5-е изд., стер. — М. : Издательский центр «Академия», 2012. — 384 с -
Герасимова Н.С., Логинова А.Ю. Расчет рН и ПР в растворах Методические указания к выполнению домашних заданий по аналитической химии Под редакцией проф. И.В. Федосеева 2009 г. -
Васильев В.П. Аналитическая химия. В 2 кн. Кн. 1. Титриметрические и гравиметрические методы анализа: Учеб. Для студ. вузов, обучающихся по химико-технол. спец. – 2-е изд., прераб. и доп. – М.: Дрофа, 2002. – 368 с.: ил. -
https://www.youtube.com/watch?v=FYoA-XQedW0 -
https://studopedia.ru/25_11700_vichislenie-rn-pri-gidrolize-soley.html
