Файл: Лабораторная работа 2 По дисциплине Химия (наименование учебной дисциплины согласно учебному плану) Тема работы Исследование реакций в растворах электролитов студент гр. Сам22 Скуковский П. А.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.03.2024
Просмотров: 8
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО науки и высшего ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей химии
Лабораторная работа №2
По дисциплине Химия
(наименование учебной дисциплины согласно учебному плану)
Тема работы: Исследование реакций в растворах электролитов
Выполнил: студент гр. САМ-22 Скуковский П.А.
(шифр группы) (подпись) (Ф.И.О.)
Оценка:
Дата:
Проверил
руководитель работы:
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2022
Цель работы:
Ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять их уравнения
Общие сведения:
Электролитом называют вещество, молекулы которого способны в растворе распадаться на ионы под действием полярных молекул растворителя. Сам процесс распада на ионы называется электролитической диссоциацией.
Количественно способность электролита распадаться (диссоциировать) на ионы характеризуют степенью диссоциации:
α = n/n0
где n – число продиссоциированных молей электролита; n0 – исходное число молей электролита.
Процесс диссоциации обратимый, он приводит к равновесию между недиссоциированными молекулами и ионами и, следовательно, должен подчиняться закону действующих масс. Вещество АВ при растворении в воде диссоциирует по уравнению:
АВ = А + + В−
При постоянной температуре отношение произведения концентраций образовавшихся ионов к концентрации непродиссоциировавших молекул электролита постоянно и называется константой диссоциации (обозначается Kd):
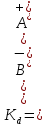
где А + , В , АВ – концентрации ионов и непродиссоциировавших молекул электролита в растворе, моль/л.
По степени и величине константы диссоциации все элетролиты принято условно делить на сильные и слабые. Сильные электролиты в растворе практически полностью диссоциируют, а слабые – частично. Закон действующих масс справедлив лишь для слабых электролитов.
К сильным электролитам относят:
-
Кислоты: азонтая (HNO3), серная (H2SO4), соляная (HCl), бромистоводородная и йодистоводородная (HBr, HI), хлорная (HClO4), хлорноватая (HClO3), -
Гидроксиды щелочных металлов, бария, стронция -
Почти все соли
Остальные электролиты являются слабыми. Мало диссоциированными соединениями являются так же комплексные ионы в растворе. Константы их диссоциации даны в справочниках.
Приведём правила написания молекулярно-ионных уравнений реакций в растворах электролитов:
-
Сильные электролиты записывают в диссоциированной форме в виде отдельных составляющих их ионов -
Слабые электролиты, сложные, в том числе и комплексные, а также малорастворимые соединения и газы записывают в молекулярной и недиссоциированной форме -
Одинаковые ионы в левой и правой частях сокращают, подобно правилам алгебры. Отсюда вытекают условия протекания реакций в растворах электролитов. -
Образование или растворение малорастворимого соединения, выпадающего в осадок -
Образование или разрушение мало диссоциированного соединения, иона или комплекса -
Выделение или растворение газа
Примеры написания уравнения реакций:
CaCl2 + 2AgNO3 = 2AgCl↓+ Ca(NO3)2;
Ag+ + Cl- = AgCl
2NH4OH + H2SO4 = (NH4)2SO4 + 2H2O;
NH4+ + OH- = NH3 + H2O.
Обработка экспериментальных данных:
Опыт 1
-
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Fe3+ + 3OH- = Fe(OH)3
Результат проведения реакции – образование бурого осадка
-
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu2+ + 2OH- = Cu(OH)2
Результат проведения реакции – образование светло-голубого осадка
-
NiSO4 + 2NaOH = Ni(OH)2↓ + Na2SO4
Ni2+ + 2OH- = Ni(OH)2
Результат проведения реакции – образование светло-зелёного осадка
Эти гидроксиды не являются сильными основаниями
Вывод: реакции протекают за счёт образования малорастворимых оснований то есть слабых электролитов
Опыт 2
2.1 Fe(OH)3 + 3HCl(р-р) = FeCl3 + 3H2O
Fe(OH)₃ + 3H⁺ = Fe³⁺ + 3H₂O
Результат проведения реакции – растворение осадка и образование желто-бурого раствора
2.2 Cu(OH)2 + 2HCl(р-р) = CuCl2 + 2H2O
Cu(OH)2 + 2H⁺ = Cu2⁺ + 2H₂O
Результат проведения реакции – растворение осадка и образование светло-голубого раствора
2.3 Ni(OH)2 + 2HCl(р-р) = NiCl2 + 2H2O
Ni(OH)2 + 2H⁺ = Ni2⁺ + 3H₂O
Результат проведения реакции – растворение осадка и образование светло-зелёного раствора
-
При растворении оснований в кислоте образовалось новое мало диссоциирующее соединение – вода
Вывод: Реакция прошла и вещества растворились в кислоте, так как образовался более слабый электролит – вода.
Опыт 3А
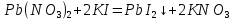
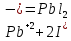
Результат проведения реакции: образование золотистого осадка
Pb(NO3)2 + BaCl2 = PbCl2↓ + Ba(NO3)2
Pb2+ + 2Cl- = Pb(Cl)2
Результат проведения реакции: образование белого осадка
Опыт 3Б
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Ba2+ + SO42- = BaSO4
Результат проведения реакции: образование белого осадка
Cr2(SO4)3 + 3BaCl2 = 3BaSO4↓ + 2CrCl3
Ba2+ + SO42- = BaSO4
Результат проведения реакции: образование белого осадка в синем растворе
В качестве осадка в опытах образуется нерастворимая соль, слабый электролит, сульфат бария BaSO4. Аналогичная реакиця будет протекать и с сульфатом железа (III)
Вывод: Реакции идут, потому что образуются мало диссоциирующее вещество – нерастворимая в воде соль BaSO4.
Опыт 4А ZnCl2 + 2NaOH(разб.) = Zn(OH)2↓ + 2NaCl
Zn2+ + 2OH- = Zn(OH)2
Результат проведения реакции: образование белого осадка
Zn(OH)2 + 2HCl(р-р) = ZnCl2 + 2H2O
Zn(OH)2 + 2H⁺ = Zn2⁺ + 2H₂O
Результат проведения реакции: растворение белого осадка
Zn(OH)2 + 2NaOH(изб.) = Na2[Zn(OH)4]
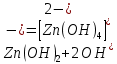
Результат проведения реакции: растворение белого осадка
Опыт 4Б Al2(SO4)3 + 6NaOH(разб.) = 2Al(OH)3↓ + 3Na2SO4
Al3+ + 3OH- = Al(OH)3
Результат проведения реакции: образование белого осадка
Al(OH)3 + 3HCl(р-р) = AlCl3 + 3H2O
Al(OH)3 + 3H⁺ = Al3⁺ + 3H₂O
Результат проведения реакции: растворение белого осадка
Al(OH)3 + 3NaOH(изб.) = Na3[Al(OH)6]
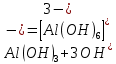
Результат проведения реакции: растворение белого осадка
Опыт 4В Cr2(SO4)3 + 6NaOH(разб.) = 2Cr(OH)3↓ + 3Na2SO4
Cr3+ + 3OH- = Cr(OH)3
Результат проведения реакции: образование зеленого осадка
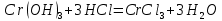
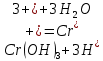
Результат проведения реакции: осадок стал темно-зеленым
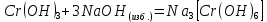
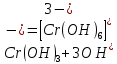
Результат проведения реакции: осадок стал серо-зеленым.
Вывод: Амфотерные гидроксиды (таких металлов как Zn, Al, Cr) в кислой среде реагирует как основание, а в щелочной как кислота.
Опыт 5 NH4Cl + NaOH = NH3↑ + H2O + NaCl
NH4+ + OH- = NH3 + H2O
Результат проведения реакции: образование газа с резким запахом.
Газ образуется из раствора из-за его небольшой растворимости в воде в виде соединения NH4OH, которое разлагается на аммиак и воду
Вывод: гидроксид аммония (NH4OH) – слабое основание, которое разлагается на аммиак и воду, реакция проходит за счёт образования аммиака и мало диссоциирующего вещества – воды.
Опыт 6
6.1 2CuSO4 + 2NH3*H2O(разб.) = (CuOH)2SO4↓ + (NH4
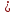 2
2
SO4
2Cu2+ + 2SO42- + 2NH4+ + 2OH- = (CuOH)2SO4 + 2NH4+ + SO42-
2Cu2+ + SO42- + 2OH- = (CuOH)2SO4
Результат проведения реакции: образование голубоватого осадка.
6.2 (CuOH)2SO4 +6NH3*H2O(изб.) + (NH4
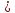 2SO4 = 2[Cu(NH3)4]SO4 + 8H2O
2SO4 = 2[Cu(NH3)4]SO4 + 8H2O(CuOH)2SO4 + 8NH4+ + 6OH- + SO42- = 2[Cu(NH3)4]SO4 + 8H2O
Результат проведения реакции: растворение осадка, образование тёмно-синего раствора
Вывод: Аммиакаты меди образуются при смешении растворов соответствующей соли и раствора аммиака. При этом образуется основная соль, которая затем растворяется вследствие процесса образования комплекса.
6.1 Реакция проходит благодаря образованию нерастворимого в воде вещества.
6.2 Реакция проходит благодаря образованию мало диссоциирующих веществ – воды и комлексных ионов в растворе.
Опыт 7А
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
2H+ + CO32- = H2O + CO2
Результат проведения реакции: образование бесцветного газа без вкуса и запаха
Общий вывод.
В ходе лабораторной работы познакомился с практическими выводами теории электролитической диссоциации, с реакциями в растворах малорастворимых оснований, изучил свойства амфотерных гидроксидов, образование малодиссоциированных соединений, комплексных соединений и газов.
