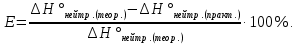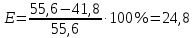Файл: Отчет по лабораторной работе 3 Тепловой эффект реакции Выполнил студент группы нгдсз222 Титов В. А.docx
Добавлен: 17.03.2024
Просмотров: 92
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего образования
Иркутский национальный исследовательский
технический университет
| Институт заочно-вечернего обучения |
| наименование института |
Отчет
по лабораторной работе №3
Тепловой эффект реакции
Выполнил студент группы: НГДСз-22-2 Титов В.А.
Проверил преподаватель: Бочкаревой С.С.
Номер зачетной книжки 22150485
Иркутск – 2023
Лабораторная работа
Определение теплоты реакции нейтрализации
Выполнение работы
Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу Н+ + ОН‾ → Н2О.
Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из двух стаканов – внешнего и внутреннего.
Работу следует выполнять в следующем порядке.
В сухой внутренний стакан калориметра с помощью мерного цилиндра налить 25 мл 1 н. раствора щелочи. В отдельный сухой стакан налить 25 мл 1 н. раствора серной кислоты. Опустить в раствор щелочи термометр. Записать температуру раствора и, не вынимая термометр из калориметра, быстро влить кислоту в щелочь. Осторожно помешивая раствор термометром, отметить и записать максимальную температуру. Эту температуру считать конечной.
Требования к результатам работы
Исходные данные и результаты расчетов занести в таблицу 1.
Таблица 1
Данные опыта и результаты расчетов
| Температура Т, К | Изменение энтальпии ∆Н, кДж | ∆Н°нейтр.практ., кДж/моль | ∆Н°нейтр. теор., кДж/моль | Относит. ошибка опыта Е, % | |
| начальная | конечная | ||||
| 26 | 31 | 1,045 | 41,8 | 55,6 | 24,8 |
1. Вычислить изменение энтальпии реакции ∆Н по формуле:
ΔH = −V ∙ ρ ∙ c ∙ ΔТ,
где V – общий объем раствора, мл; ρ – плотность раствора, г/мл; с – теплоемкость раствора, Дж/(г∙К); ΔТ – разность между конечной и начальной температурами. Принять плотность раствора после нейтрализации равной 1 г/мл, а теплоемкость раствора − равной теплоемкости воды, т.е. 4,18 Дж/(г∙К).
ΔH =50 ∙ 1∙ 4,18 ∙ 5=1,045
2. Вычислить тепловой эффект реакции нейтрализации ∆Н°нейтр.(практ.) в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л раствора (концентрация равна 1 н.), а для реакции было взято 25 мл, то

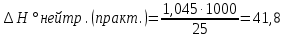
3. Используя следствие из закона Гесса, рассчитать теоретическое значение изменения энтальпии реакции нейтрализации ∆Н°нейтр.(теор.) для уравнения реакции:
Н+ + ОН‾ → Н2О.
Значения стандартных термодинамических функций состояния системы приведены в таблице 2.
Таблица 2
Стандартные энтальпии образования ∆Н°298
| Вещество | ∆Н°298, кДж/моль |
| Н+ | - |
| ОН‾ | -230,2 |
| Н2О | -285,8 |
Н+ + ОН‾ → Н2О.
Значения стандартных термодинамических функций состояния системы :
ОН-: - 230,2 кДж /моль
Н2О: - 285,8 кДж/моль
Теоретическое значение
ΔН° = - 285,8-(-230,2)=-55,6
4. Рассчитать относительную ошибку опыта Е (%):