Файл: Лабораторная работа 1 исследование реакций в расстворах электролитов студент гр. Гнг22 Мосина П. А.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.03.2024
Просмотров: 8
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
П

ЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
ОТЧЕТ
ЛАБОРАТОРНАЯ РАБОТА № 1
«ИССЛЕДОВАНИЕ РЕАКЦИЙ В РАССТВОРАХ ЭЛЕКТРОЛИТОВ»
Выполнил: студент гр. ГНГ-22 _________ /Мосина П.А. /
(подпись) (Ф.И.О.)
Проверил: _________ / /
(подпись) (Ф.И.О.)
Санкт-Петербург
2022
Цель работы: ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять уравнения.
Общие сведения:
Электролитической диссоциацией называется процесс распада молекул электролитов на ионы под действием полярных молекул растворителя.
Количественно способность электролита распадаться на ионы характеризуют степенью диссоциации
α = n/n0,
где n - число продиссоциированных молей, n0 - исходное число молей электролита.
Процесс диссоциации обратимый, он приводит к равновесию между недиссоциированными молекулами и ионами и, следовательно, должен подчиняться закону действующих масс. Вещество АВ при растворении в воде диссоциирует по уравнению
АВ А+ + В- .
При постоянной температуре отношение произведения концентраций конечных и исходных веществ постоянно и называется константой диссоциации.
Кд = [А+]*[B-]/[AB],
где [А+], [В- ], [АВ] - концентрации ионов и молекул электролита в растворе, моль/л или моль/кг.
По степени и величине константы диссоциации все
электролиты принято условно делить на сильные и слабые. Сильные электролиты в растворе диссоциируют практически полностью, слабые - частично. Закон действующих масс справедлив лишь для слабых электролитов.
Условия протекания реакций в растворах электролитов:
-
Образование или растворение малорастворимого соединения, выпадающего в осадок. -
Образование или разрушение малодиссоциированного соединения, иона или комплекса. -
Выделение или растворение газа.
Порядок выполнения работы:
Опыт 1.
FeCl3 + 3NaOH =Fe (OH) 3 + 3NaCl
Fe3+ + 3
 +3Na++ 3
+3Na++ 3 = Fe (OH) 3 + 3Na+ + 3
= Fe (OH) 3 + 3Na+ + 3
Fe3+ + 3
 = Fe (OH) 3
= Fe (OH) 3( Образование осадка бурого цвета)
CuSO4 + 2NaOH= Cu (OH) 2+ Na2SO4
Cu2+ +
 + 2Na++ 2OH= Cu (OH) 2 +2Na++
+ 2Na++ 2OH= Cu (OH) 2 +2Na++
Cu2+ + 2OH= Cu (OH) 2
( Образование осадка голубого цвета)
NiSO4 + 2NaOH= Ni (OH) 2+ Na2SO4
Ni2+ +
 + 2Na++2
+ 2Na++2 =Ni (OH) 2+
=Ni (OH) 2+ + 2Na+
+ 2Na+Ni2 +2
 =Ni (OH) 2
=Ni (OH) 2( Образование осадка светло-зеленого цвета)
Ответы на вопросы:
Являются ли полученные гидроксиды сильными основаниями?
– Полученные гидроксиды не являются сильными основаниями.
Вывод: в ходе реакций идет образование осадков.
Опыт 2.
Fe (OH) 3 + 3HCl (р-р)=FeCl3+ 3H2O
Fe (OH) 3 + 3H++ 3
 =Fe3+ + 3H2O+ 3
=Fe3+ + 3H2O+ 3
Fe (OH) 3 + 3H+ =Fe3+ + 3H2O
( Образование воды и творожистого осадка)
Cu (OH) 2 + 2HCl (р-р) =CuCl2
+ 2 H2O
Cu (OH) 2+ 2H+ + 2
 =Сu2++ 2
=Сu2++ 2 + 2 H2O
+ 2 H2OCu (OH) 2+ 2H+ =Сu2+ + 2 H2O
(Образование воды и творожистого осадка)
Ni (OH) 2 + 2HCl (р-р) =NiCl2 + 2H2O
Ni (OH) 2 + 2H+ + 2
 =Ni2+ + 2
=Ni2+ + 2 + 2H2O
+ 2H2ONi (OH) 2 + 2H+ =Ni2+ + 2H2O
( Образование воды и творожистого осадка)
Ответы на вопросы:
Какое новое малодиссоциированное соединение образуется при растворении оснований в кислоте?
– Образуется вода.
Вывод: вещества растворились в кислоте
Опыт 3 (А).
Pb (NO3) 2 + 2KJ =PbJ2 + 2KNO3
Pb2+ +2
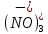 + 2K+ +2J =PbJ2 +2
+ 2K+ +2J =PbJ2 +2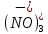 + 2K+
+ 2K+Pb2+ + 2
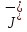 =PbJ2
=PbJ2( Образование осадка ярко-желтого цвета)
Pb (NO3) 2 +BaCl2 =PbCl2 + Ba (NO3) 2
Pb2+ +2
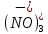 + Ba2++ 2Cl =PbCl2 + Ba2++2
+ Ba2++ 2Cl =PbCl2 + Ba2++2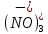
Pb2+ + 2
 =PbCl2
=PbCl2(Образование осадка в виде белых хлопьев)
Ответы на вопросы:
Что наблюдается в каждой пробирке?
–В результате проведенных реакций, в первой пробирке мы можем наблюдать выпадение осадка ярко-желтого цвета, а во второй пробирке образование осадка в виде белых хлопьев.
Вывод: реакции произошли, по причине образования малорастворимых и нерастворимых веществ.
Опыт 4 (В).
Cr2 (SO4)3 + 6 NaOH =2Cr (OH) 3+3Na2SO4
2Cr3+ +3
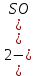 + 6Na++ 6
+ 6Na++ 6 =2Cr (OH) 3+ 6Na
=2Cr (OH) 3+ 6Na
++ 3
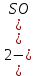
Cr3+ + 3
 =Cr (OH) 3
=Cr (OH) 3(Образование осадка темно-зеленого цвета)
Cr (OH) 3 +3HCl= CrCl3 +3H2O
Cr (OH) 3 +3H+ +3
 = Cr3+ +
= Cr3+ + +3H2O
+3H2OCr (OH) 3 +3H+ = Cr3+ +3H2O
(Образование осадка синего цвета)
Cr (OH)3 + 3 NaOH (в избытке) =Na3 [Cr (OH) 6]
Cr (OH)3 + 3Na++ 3
 =[Cr (OH) 6] 3-- + 3Na+
=[Cr (OH) 6] 3-- + 3Na+Cr (OH)3 + 3
 =[Cr (OH) 6] 3--
=[Cr (OH) 6] 3-- (Образование осадка ярко-синего цвета)
Вывод: в ходе реакций можно заметить, что амфотерные гидроксиды взаимодействуют как с кислотами, так и с щелочами.
Опыт 6.
2CuSO4 +2 NH4(OH)разб. =(CuOH)2SO4 + (NH4)2 SO4

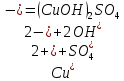
(Образование осадка голубого цвета)
(CuOH)2SO4 + (NH4)2 SO4 +6NH4(OH)конц. =2[Cu (NH3) 4] SO4 + 8Н2О
(CuOH)2SO4 + 2(NH4)+ +
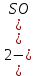 +6NH4+ +
+6NH4+ +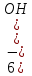 =2[Cu (NH3) 4] SO4 + 8Н2О
=2[Cu (NH3) 4] SO4 + 8Н2О(Образование осадка ярко-синего цвета)
Ответы на вопросы:
Какую окраску имеет образующийся растворимый амминокомплекс меди?
– Растворимый амминокомплекс меди имеет синюю окраску.
Вывод: реакция произошла по причине образования малодиссоциирующих соединений.
Вывод: Благодаря выполненной работе познакомилась с практическими выводами теории электролитической диссоциации, с реакциями в растворах малорастворимых оснований, изучила свойства амфотерных гидроксидов, образование малодиссоциированных соединений, комплексных соединений и газов.


