Файл: Решение Молярная концентрация эквивалента серной кислоты (нормальная концентрация).docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.03.2024
Просмотров: 6
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.

27. Щелочной сток предприятия имеет щелочность 20 ммоль/л и расход воды ‒ 200м3. Кислый сток того же предприятия содержит серную кислоту в количестве 980 мг/л, объем стока – 100м3. Какая реакция среды будет при смешивании равных объемов этих стоков и каков будет количественный показатель кислотности или щелочности (ммоль/л)? В каких объемах нужно смешать эти стоки, чтобы произошла их взаимная нейтрализация?
Решение:
Молярная концентрация эквивалента серной кислоты (нормальная концентрация):
С(1/2Н2SО4) = С/М(1/2Н2SО4) = 980 / 49 = 20 ммоль/л,
где С – массовая концентрация серной кислоты;
М(1/2Н2SО4) - молярная масса эквивалента серной кислоты, равная
М(1/2Н2SО4) = М(Н2SО4) / 2 = 98 / 2 = 49 мг/ммоль
Сравнения полученной величины со щелочностью щелочного стока показывает, что сток станет нейтральным при смешении стоков равных объемов.
Вычислим объем щелочного стока для нейтрализации кислого стока объемом 100 м3:
Сщел · Vщел = Скисл · Vкисл
Vщел = Скисл · Vкисл / Сщел = 20 · 100 / 20 = 100м3 – следовательно, стоки нужно смешать в равных объемах.
37. Рассчитайте карбонатную, некарбонатную, общую жесткость воды, если в ней содержится гидрокарбонат – ионов – 256 мг/л, ионов кальция – 80,12 мг/л, ионов магния – 36,6 мг/л.
Решение:
1). Жесткость общую рассчитывают по формуле:
Жо =
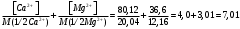 ммоль/л
ммоль/лгде: [Са2+], [Mg2+] – концентрация ионов в мг /л;
М (1/2Са2+), М (1/2Mg2+) – эквивалентная масса ионов Са2+ и Mg2+, которая равна:
М (1/2Са2+) =
М(1/2Mg2+) =
2 Карбонатная жесткость воды обусловлена наличием соли гидрокарбоната и вычисляется:
Жк =
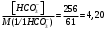 ммоль/л
ммоль/лМ(1/1НСО3-) – эквивалентная масса иона НСО3-, которая равна:
М (1/1НСО3-) =
3) Рассчитываем жесткость некарбонатную (Жнк), как разность между жесткостью общей и карбонатной:
Жнк = Жо – Жк = 7,01 – 4,20 = 2,81 ммоль/л
