Добавлен: 18.03.2024
Просмотров: 14
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Вариант №16
Комплексная задача №2
В настоящее время в системах противопожарной безопасности небольших объектов, подлежащих защите системами автоматического пожаротушения, все большее распространение получают автоматические установки газового пожаротушения. Составной частью таких установок пожаротушения является стальной баллон, в котором находится сжиженное или сжатое газовое огнетушащее вещество (ГОТВ) [5]. В баллоне емкостью V1 дм3 находится m1 кг ГОТВ (определяется вариантом задания) под давлением p1 атм. Задания:
1.Часть газа была взята для работы, при этом давление в баллоне понизилось до p2 атм. Какое количество ГОТВ m2 кг осталось в баллоне, если температура во время отбора не изменилась?
2.Какой объем V2 м 3 займет m2 кг ГОТВ при н.у.?
3.Во сколько раз уменьшилось количество молекул ГОТВ в баллоне после его использования (см.п.1)?
4.Какова плотность ГОТВ по воздуху?
-
Cогласно закону Бойля-Мариотта: при постоянной температуре абсолютное давление, производимое данной массой газа обратно пропорционально объему газа:
P1V1 = P2V2 илиPV = const
V2=
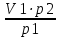 =20л
=20лm=pV=1,98‧20=39,6 г
-
pV=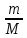 RT
RT
32V=
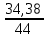 ‧8,31‧273
‧8,31‧273V=55 л
-
N= vNa, v=39,6:44=0,9 моль
N=5,42‧10-23 моль
-
D(CO2)(воздух)=44:29=1,51
Комплексная задача №3
При проектировании цеха по производству химического вещества (Х) в промышленных масштабах необходимо указать расположение вентиляционных шахт для вывода людей из рабочей зоны, в которой возможно возникновение чрезвычайной ситуации. Задания (вещество Х определяется вариантом):
1. Рассчитать молярную массу газообразного вещества (Х) по указанной относительной плотности газа;
2. Используя состав вещества (Х) в массовых процентах, определить формулу вещества (Х);
3. Определите порядковые номера, число нейтронов, число протонов,
число электронов, номер периода и номер группы периодической системы химических элементов, в которых находятся атомы элементов, входящих в состав молекулы.
4. Напишите электронную формулу атомов химических элементов, входящих в состав молекулы. Определите электронные семейства, к которым относятся элементы.
5. Определите квантовые числа валентных электронов в наиболее электроотрицательном атоме, входящем в состав молекулы.
6. Используя метод валентных связей, показать образование молекулы (Х);
7. Определите степени окисления атомов в молекуле.
6.Сравните окислительно-восстановительные, кислотно-основные свойства атомов химических элементов, входящих в состав молекулы, проанализировав их положение в периодической таблице Д.И. Менделеева.
8. Определите тип химической связи в молекуле (Х) на основании разности электроотрицательностей атомов (электроотрицательности приведены в Приложении 2 табл. 1).
9. Оценить пожарную опасность (горючее вещество или окислитель) химического вещества (Х), используя справочник [4]
Решения:

-
M(x)=D(Cl2)‧M(Cl2)=1,14‧71=80,94 -
v(H)=2,49 моль
v(Se)=97,51:79=1,2 моль
v(H):v(Se)=2:1
Простейшая формула H2Se
Делим молярную массу H2Se на молярную массу вещества x и получаем 1, следовательно H2Se истинная формула.
-
H-1 электрон и протон, 1 нейтрон, 1 группа и период
N-7 протона и электрона, 7 нейтронов, 2 период и 5 группа.
-
Электронная формула азота- 1s2 2s2 2p3
Электронная формула водорода- 1s1
Водород-s элемент
Азот-p элемент
-
Валентные электроны водорода-1
Количество валентных электронов в атоме водорода - 1.
Ниже приведены их квантовые числа (N - главное, L - орбитальное, M - магнитное, S - спин)
Количество валентных электронов в атоме азота - 5.
Ниже приведены их квантовые числа (N - главное, L - орбитальное, M - магнитное, S - спин)
6)

7) CO в NH
3= H+1, N-3
8) Ковалентная полярная
9) Водород (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1, самый лёгкий из элементов периодической таблицы. Его одноатомная форма — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы.
Три изотопа водорода имеют собственные названия: 1H — протий, 2H — дейтерий и 3H — тритий (радиоактивен). Ядро самого распространённого изотопа, протия, состоит из одного только протона и не содержит нейтронов.
При стандартных температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен. В присутствии других окисляющих газов, например фтора или хлора, водород также взрывоопасен. Поскольку водород охотно формирует ковалентные связи с большинством неметаллов, большая часть водорода на Земле существует в молекулярных соединениях, таких как вода или органические вещества. Водород играет особенно важную роль в кислотно-основных реакциях.
Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии.
Итог: пожароопасен
Азот (N, лат. nitrogenium) — химический элемент 15-й группы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе V группы, или к группе VA), второго периода периодической системы с атомным номером 7.
Относится к пниктогенам.
Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха.
Один из самых распространённых элементов на Земле.
Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов.
Основной компонент воздуха (78,09 % объёма), разделением которого получают промышленный азот (более ¾ идёт на синтез аммиака).
Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент.
Азот — один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот.
Комплексная задача № 4
На складе химических реактивов был обнаружен ряд склянок без этикеток. Задания:
1.К какому классу неорганических соединений по традиционной классификации относятся указанные вещества. Назовите эти вещества.
2.Определите степень окисления атомов элементов, входящих в состав предложенных соединений.
3.Оцените растворимость веществ в воде.
4.Оцените возможность протекания реакций при смешении веществ, если в склянках находятся реактивы, указанные в варианте комплексной задачи. Назовите продукты реакций.
5.Оценить по справочнику [4], какая реакция представляет собой наибольшую пожарную опасность. Сделать вывод, какие вещества несовместимы при хранении друг с другом.

-
HI(йодовородная кислота)- класс бескислородныз кислот
NaOH(гидроксид натрия)- класс оснований
-
СО в HI= H+1, I-1
CO в NaOH= Na+1,O-2,H+1
-
Оба вещества хорошо растворимы в воде -
Вступают в реакцию нейтрализации:
NaOH+HI=NaI+H2O
-
При взаимодействии данных веществ взрывоопасность и пожароопасность является минимальной, но это возможно так как гидроксид- пожароопасен
Комплексная задача (растворы электролитов) № 5
При очистке реактора установки по производству соли (определяется номером варианта, столбец 2) часть продукта осталась не изъятой. Определить:
1. Концентрацию (СМ, Сm, Х, ω) раствора соли, если в реакторе её осталось 5 кг, а объём воды, необходимый для первичной отмывки реактора в 10 раз больше, чем для образования насыщенного раствора этой соли (S, г на 100 г воды, столбец 3).
2. При растворении соли в воде возможен её гидролиз. Запишите соответствующие уравнения процесса. Определите pH образовавшегося раствора (рН < 7, pH > 7, pH ≈ 7)

-
S(CoCl2)=55,3 г/100 г воды
100 г воды-52,9(CoCl2)
1000 г воды- х г (CoCl2)
m(CoCl2)=529 г
1000 г воды-529 г
Х- 5000 г
m(H2O)=9452
m р-ра= 9452+5000=14452 г
w= 5000:14452‧100=34,60%
CM=v/Vр-ра
v=m/M=5000:130=38,46
Vр-ра=14452 мл
CM=38,46/моль:14452мл=0,002 моль/мл
Сm=0,002 моль/мл‧1000мл=2,4моль
-
CoCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
ПЕРВАЯ СТАДИЯ (СТУПЕНЬ) ГИДРОЛИЗА
Молекулярное уравнение
CoCl2 + HOH ⇄ CoOHCl + HCl
Полное ионное уравнение
Co2+ + 2Cl- + HOH ⇄ CoOH+ + Cl- + H+ + Cl-
Сокращенное (краткое) ионное уравнение
Co2+ + HOH ⇄ CoOH+ + H+
ВТОРАЯ СТАДИЯ (СТУПЕНЬ) ГИДРОЛИЗА
Молекулярное уравнение
CoOHCl + HOH ⇄ Co(OH)2 + HCl
Полное ионное уравнение
CoOH+ + Cl- + HOH ⇄ Co(OH)2 + H+ + Cl-
Сокращенное (краткое) ионное уравнение
CoOH+ + HOH ⇄ Co(OH)2 + H+
СРЕДА И PH РАСТВОРА ХЛОРИДА КОБАЛЬТА (II) В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7).
Комплексная задача (растворы неэлектролитов) № 6
В технологическом процессе завода химического синтеза первичный подогрев вещества Х (столбец 2) осуществляется в трубчатых змеевиках, а для повышения производительности установки в Х вводят вещество Y. Определить температуру кипения и замерзания раствора, содержащего m 7 (кг) вещества Х и n (моль) вещества Y (столбец 3, 4), если для Х Кк = а моль С кг о (столбец 5), Кэ = b моль С кг о (столбец 6), t зам = с 0С (столбец 7), t кип = d 0С (столбец 8).
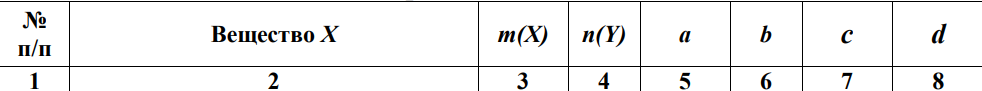

m(X)- масса растворителя по условия она равна 5 кг
n(Y)=m/M=31:160=19 моль
Тогда повышение температуры кипения составит:
Соответственно температура кипения равна:
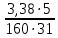 =0,003 °C
=0,003 °CНайдем температуру замерзания по формуле:
