Добавлен: 18.03.2024
Просмотров: 15
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
 = Кэ‧m(x)=3,38
= Кэ‧m(x)=3,38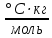 ‧5 кг=16,9 °C.
‧5 кг=16,9 °C.Комплексная задача № 8
В гальваническом цехе завода «Точ прибор» происходит нанесение металлических покрытий металлом У на детали машин, сделанных из металла Х. Определить (используя приложение 6, табл.1.):
1.ЭДС концентрационного гальванического элемента, электродами которого являются металлы Х (столбец 2) и У (столбец 3) (электроды погружены в растворы своих солей), а концентрация растворимых солей Х и У составляют значения согласно варианту задания (столбец 6, 7).
2.В процессе электролитического нанесения покрытия детали из металла Х, на её поверхности осаждается (m, г) металла У. Вычислить массу металла У, если электролитический процесс протекает при силе тока, равной I, А (столбец 5), в течение секунд (столбец 4).
-
Гальвинический элемент образован цинковым и магниевым электродами погруженные в растворы солей
При сравнении стандартных электродных потенциалов
Е0Zr≥ Е0Fe
Стандартные электронные потенциалы:
| Электрод | Электродная реакция | Е0,В |
| Zr+4/Zr | Zr+4+4e-Zr | -1,53 |
| Fe+2/Fe | Fe+2+2e-Fe | -0,44 |
Концентрация ионов циркония=1.53
Концентрация ионов железа=0.44
По уравнению Нернста ???? = ???? 0 + ???? ∙ ???? ???? ∙ ???? ∙ ???????????????? = ???? 0 + 0,059 ???? ∙ ????????????????
где E0 – стандартный электродный потенциал, В; R=8,314 кДж/(моль К) – универсальная газовая постоянная; Т – температура процесса, К; F=96500 - число Фарадея; n – число переходящих электронов.
Е0 Zn+4/Zn = Е0 Zr+4/Zr +0,059:n‧???????????? Е0 Zr+4/Zr =-1,538B
Е0 Fe+2/W = Е0 Fe+2/Fe+0,059:n‧???????????? Е0 Fe+2/Fe =-0,446B
-
Законы электролиза: Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит электричества выражается законом Фарадея: Масса вещества, выделившегося на электродах при электролизе, прямо пропорциональна количеству электричества, прошедшего через электролит.
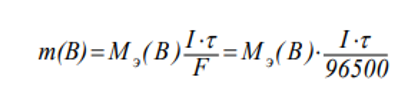

m(B)=59‧
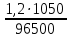 =0,73 г
=0,73 г-
Тип покрытия-химический
Горячий метод — защищаемое изделие погружают в расплавленный металл. Покрытие (например, из Zn, Sn, Pb и др.) образуется после извлечения его из ванны.
Комплексная задача № 9
В полом технологическом аппарате ёмкостью V1 л (столбец 3), рассчитанном на максимальное давление p1 атм. (столбец 4) проводят исследования по определению пожаровзрывоопасных показателей взрывчатого вещества.
Задания:
1.Определить максимальную массу вещества, которую можно подавать в технологический аппарат, если разложение этого вещества при взрыве протекает по реакции, указанной в варианте задания (температура взрыва t oC – столбец 5)?
2.Определить объем газа (приведенный к н.у.), который получается при взрыве 1 кг взрывчатого вещества.
3.Определить теплоту взрывчатого разложения вещества (∆H х. р.), оцентите не прибегая к расчётам ΔS 0 х.р..
4.Какие процессы окисления и восстановления соответствуют уравнению реакции.

V=P0V0T:T0P=101,3‧22,4‧4273:273‧2026=17,5 л
X=0,1:17,5=0,01
Согласно уравнению реакции 1 моль гексогена образует 1 моль газовой смеси не более 0,01 моль
1 моль нитрометана=61 г/моль
Х=61г/моль‧0,01моль=0,61 г
-
V=P0V0T:T0P=101,3‧22,4‧4273:273‧2026=17,5 л -
Определить объем продуктов взрыва 1 кг нитрометана
Взрывчатое разложение:
V0=
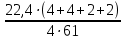 =1,47 м3/кг.
=1,47 м3/кг.-
Нитрометан- восстановителем процесс окисления
Комплексная задача № 10
В замкнутом технологическом режиме протекает процесс, указанный в варианте задания (табл. 24). Для указанного процесса записать и рассчитать:
1. Математическое выражение для скорости прямой и обратной реакции;
2. Вычислить, используя правило Вант-Гоффа, на сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 50 раз. Температурный коэффициент скорости реакции равен 2,5.
3. Выражение для расчета Кр указанной реакции в общем виде.

-
Из закона действующих масс известно, что при постоянной температуре скорость химической реакции (V) зависит от природы вещества, выражаемой через константу скорости (k), и концентрации реагирующих веществ, возведенные в степень, равную числу молей веществ в уравнении химической реакции ([A]a).
Для газообразных веществ вместо концентраций можно использовать парциальные давления газов (РаА).
Если вещества твердые, то их концентрация остается постоянной и принимается равной единице. В кинетическом
уравнении концентрация твердых веществ не учитывается.
Таким образом, для первой реакции а), которая является гомогенной, закон действующих масс выражается следующими уравнениями:
для прямого направления
Vпр. = kпр. [O2]·[O3],
если концентрации веществ выразить через парциальные давления, то
Vпр. = kпр.·РO2 PO3 ;
для обратного направления
Vобр. = kобр. [O3]·[O2], или
Vобр. = kобр.Р(О3) P(O2) .
Число молекул реагентов, принимающих участие в
простейшей (элементарной) стадии, называется ее
молекулярностью (М). Элементарный акт представлен уравнением химической реакции.
| Мпр. = 1 + 1 = 2; | Мобр. = 1 + 1 = 2. |
Порядок реакции показывает, как природа вещества влияет на зависимость скорости реакции от концентрации (или парциального давления) реагирующих веществ.
Порядок реакции (П) определяется суммой величин показателей степеней при значениях концентрации (парциального давления) реагирующих веществ. Порядок рассчитывается с использованием
| закона действующих | масс. Тогда для вариантов: |
Ппр.= 1 + 1= 2;
Побр. = 1 + 1 = 2
-
Влияние температуры на скорость химической реакции определяется законом Вант-Гоффа: При повышении температуры на каждые 10 0С скорость гомогенной химической реакции увеличивается в 2-4 раза. Закон Вант-Гоффа выражается соотношением: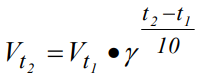 скорость реакции при температуре t1, vt2 скорость реакции при температуре t2, коэффициент Вант-Гоффа, показывающий во сколько раз увеличится скорость реакции при увеличении температуры на 10 градусов.
скорость реакции при температуре t1, vt2 скорость реакции при температуре t2, коэффициент Вант-Гоффа, показывающий во сколько раз увеличится скорость реакции при увеличении температуры на 10 градусов.
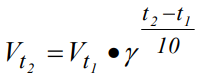
50=
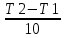 ,
, 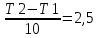
Температуру нужно повысит на 25 градусов.
-
Для гомогенной газовой реакции константу равновесия удобнее выразить через парциальные давления веществ:
Vпр. = kпр. [O2]·[O3],
если концентрации веществ выразить через парциальные давления, то
Vпр. = kпр.·РO2 PO3 ;
для обратного направления
Vобр. = kобр. [O3]·[O2], или
Vобр. = kобр.Р(О3) P(O2) .
