ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 8
Скачиваний: 0
Буферные растворы, их состав, свойства и механизм действия.
Растворы, способные сохранять постоянной концентрацию ионов Н+ при добавлении к ним небольших количеств сильной кислоты или щелочи, а также при разбавлении, называются буферными растворами или буферными системами.
Свойство данных растворов сохранять неизменным присущее им значение рН при вышеперечисленных обстоятельствах, называется иначе буферным действием.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
Кислотные буферные системы обычно образованы слабой неорганической или органической кислотой и солью этой же кислоты с сильным основанием.
Кислотная буферная система может быть образована и смесью двух солей многоосновной кислоты, соответствующих различным стадиям нейтрализации этой кислоты. В этом случае кислотный остаток одной из солей (менее замещенный) играет роль слабой кислоты, а кислотный остаток второй соли (более замещенный) – сопряженного ей основания.
Оснóвные буферные системы образованы слабым неорганическим или органическим основанием и солью этого основания с сильной кислотой.
Таким образом, любая кислотно-основная буферная система является равновесной смесью, состоящей из донора и акцептора протонов.
Механизм действия кислотных буферных систем:
Сущность буферного действия смеси слабой кислоты с ее солью можно рассмотреть на примере ацетатного буферного раствора. При добавлении к нему сильной кислоты (например, HCl) происходит реакция:
CH3COONa + HCl = NaCl + CH3COOH – молекулярное уравнение
CH3COO– + Na+ + H+ + Cl– = Na+ + Cl– + CH3COOH – полное ионное уравнение
H+ + CH3COO– = CH3COOH – сокращенное ионное уравнение
В результате этого воздействия сильная кислота замещается на эквивалентное количество плохо диссоциированной слабой кислоты буферной системы, поэтому концентрация ионов Н+ (активная кислотность) в растворе существенно не изменяется. Пока солевая компонента буферной системы не расходуется в данной реакции раствор в той или иной степени будет сохранять свое буферное действие. При добавлении к буферной смеси сильного основания (например, NaOH) происходит реакция:
CH3COOH + NaOH = CH3COONa + H2O – молекулярное уравнение
CH3COOH + Na+ + OH– = CH3COO– + Na+ + H2O – полное ионное уравнение
CH3COOН + OH– = CH3COO– + H2O – сокращенное ионное уравнение
В результате сильное основание замещается на эквивалентное количество нейтральной соли буферной системы, поэтому концентрация ионов водорода в ней опять изменится незначительно. Буферное действие раствора при этом будет наблюдаться пока полностью не расходуется слабая кислота. Если к буферному раствору попеременно добавлять в небольших количествах сильную кислоту или щелочь, то его буферное действие сможет сохраняться более длительное время, т.к. в результате протекающих реакций буферная система будет периодически восстанавливать свой первоначальный количественный и качественный состав. Для кислотной буферной системы, образованной двумя солями механизм действия будет аналогичным. Рассмотрим его на примере фосфатного буфера: NaH2PO4 + Na2HPO4. Добавленная к нему сильная кислота провзаимодействует с солевой компонентой системы и заместится на эквивалентное количество компоненты, играющей роль слабой кислоты. Na2HPO4 + HCl = NaH2PO4 + NaCl – молекулярное уравнение
2Na+ + HPO42– + H+ + Cl– = 2Na+ + H2PO4– + Cl– – полное ионное уравнение
HPO42– + H+ = H2PO4– – сокращенное ионное уравнение
Внесенная щелочь, наоборот, заместится на эквивалентное количество нейтральной солевой компоненты буфера:
NaH2PO4 + NaOH = Na2HPO4 + H2O – молекулярное уравнение
Na+ + H2PO4– + Na+ + OH– = 2Na+ + HPO42– + H2O – полное ионное уравнение
H2PO4– + OH– = HPO42– + H2O – сокращенное ионное уравнение
Механизм действия основных буферных систем:
Механизм действия основных буферных систем рассмотрим на примере аммиачного буфера. Добавленная к нему сильная кислота провзаимодействует со слабым основанием и заместится на эквивалентное количество солевой компоненты буфера:
NH3 + HCl = NH4Cl – молекулярное уравнение
NH3 + H+ + Cl– = NH4+ + Cl– – полное ионное уравнение
NH3 + H+ = NH4+ – сокращенное ионное уравнение
Щелочь вступит в реакцию с солью буферной системы и вместо нее образуется эквивалентное количество слабого основания:
NH4Cl + NaOH = NH3 + H2O + NaCl – молекулярное уравнение
NH4+ + Cl– + Na+ + OH– = NH3 + H2O + Na+ + Cl– – полное ионное уравнение
NH4+ + OH– = NH3 + H2O – сокращенное ионное уравнение
Таким образом, рассмотренные примеры показывают, что буферное действие растворов независимо от их состава обусловлено взаимодействием внесенных в них ионов Н+ или ОН– с соответствующим компонентом буфера. В результате этого происходит их связывание в растворе за счет образования слабодиссоциированного продукта реакции, т.е. (говоря другими словами) перевод в потенциальную кислотность либо основность. Вследствие этого активная кислотность (основность) самой буферной системы существенно не изменяется и остается на первоначальном уровне.
Основное уравнение буферных растворов.

Буферная ёмкость, её определение. Буферность почв и почвенного раствора.
Способность буферных систем противодействовать резкому изменению рН при добавлении к ним сильной кислоты или основания является ограниченной. Буферная смесь поддерживает рН постоянным только при условии, что количество вносимых в раствор сильной кислоты или щелочи не превышает определенной величины. В противном случае наблюдается резкое изменение рН, т.е. буферное действие раствора прекращается.
Это связано с тем, что в результате протекающей реакции изменяется соотношение молярных концентраций компонентов буферной системы: Скислоты/Ссоли или Соснования/Ссоли.
При этом концентрация компонента, реагирующего с добавленной кислотой или щелочью, уменьшается, а концентрация второго компонента возрастает, т.к. он дополнительно образуется в ходе реакции. Количественно буферное действие раствора характеризуется с помощью буферной емкости (В). При этом различают буферную емкость по кислоте (Вк.) и буферную емкость по основанию или щелочи (Во.). Буферной емкостью по кислоте является то количество химического эквивалента сильной кислоты, которое нужно добавить к 1 литру (1 дм3) буферной системы, чтобы уменьшить еѐ рН на единицу. Ее можно рассчитать по следующей формуле:
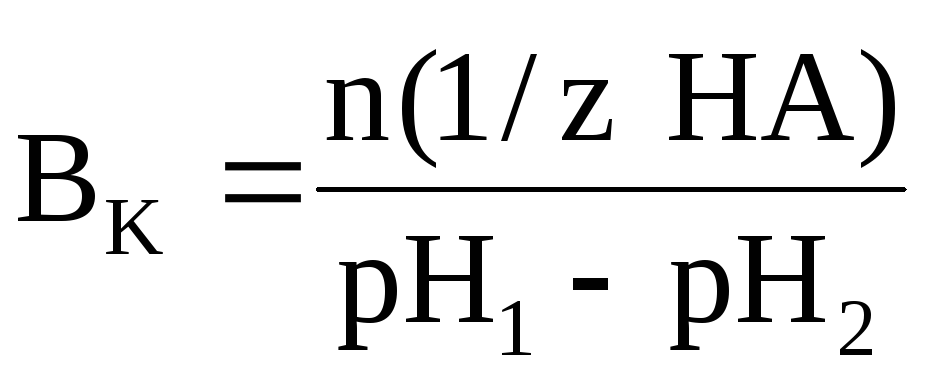
где n(1/z HA) – число молей химического эквивалента сильной кислоты, добавленное к 1 литру буферной системы;рН1 – водородный показатель системы до добавления сильной кислоты;рН2 – водородный показатель системы после добавления сильной кислоты.
БУФЕРНОСТЬ ПОЧВЫ, буферная способность почвы - способность её противостоять изменениям реакции. Благодаря Б. почв их реакция, при добавлении небольших количеств кислот или щелочей, сравнительно мало меняется, что очень важно для произрастания р-ний на почвах и развития в них микроорганизмов.
Буферной способностью обладает твёрдая часть почв и в меньшей степени почвенный раствор. В нейтральных и слабокислых почвах буферная способность почвенных растворов зависит б. ч. от наличия в них буферной системы из углекислоты и бикарбоната кальция. При добавлении к указанной буферной системе сильной кислоты образуется нейтрально реагирующая кальциевая соль последней и слабая кислота - СO2 в свободном состоянии; так. обр., вместо сильной кислоты в почвенном растворе остаётся слабая кислота, благодаря чему кислотность раствора мало повышается. Свободные щёлочи, в случае их прибавления к этой буферной системе, связываются углекислотой в углекислые соли [напр., Са(ОН)2 в трудно растворимый углекислый кальций], вследствие чего резкого подщелочения реакции не происходит. При наличии в почвенном растворе буферной системы из углекислоты и бикарбоната кальция рН раствора обычно колеблется в пределах от 5,3 до 8,4.
Буферность почвенных растворов может обусловливаться также наличием в них др. буферных систем - из фосфорной кислоты и её солей, органических кислот и их солей, солей алюминия и пр. или содержанием в почвенном растворе амфотерных веществ, обладающих способностью связывать как водородные, так и гидроксильные ионы (аминокислоты, гуминовые вещества и т. д.).
Состав почвенного раствора и, следовательно, его буферные свойства зависят от свойств твёрдой части почвы; последняя, в основном, и определяет буферность почв.
Буферность твёрдой части почв обусловливается способностью органических и минеральных коллоидов к поглощению катионов (см. Поглотительная способность почвы). Поглощённые почвой основания обусловливают Б. п. по отношению к кислотам. Последние при их добавлении к почве нейтрализуются, в результате обменных реакций с поглощёнными основаниями, по уравнению:
![]()
![]()
С др. стороны, Б. п. по отношению к щелочам обусловливается нейтрализацией последних поглощёнными ионами водорода по уравнению:
![]()
![]()
* (В поглощающем комплексе почвы)
** (Водородные ионы кислоты и кальций соли в растворе)
Для определения Б. п. предложены спец. лабораторные методы. Можно судить о буферной способности почв и не пользуясь этими методами, зная количество и состав поглощённых катионов в почве.
Б. п. имеет большое значение для плодородия почвы и для применения удобрений. Чем больше Б. п., тем обычно выше их плодородие. Минеральные удобрения (особенно в кислых формах) на почвах с высокой буферной способностью лучше используются; наоборот, на почвах с низкой буферной способностью кислые формы минеральных удобрений могут дать неполный эффект или даже снизить урожаи.
Известь на почвах с малой буферной способностью по отношению к кислотам и высокой - по отношению к основаниям обычно даёт больший эффект и должна применяться в повышенных дозах.
Повышение Б. п. на малобуферных почвах м. б. достигнуто как в результате применения органических удобрений (навоз, торф, зелёное удобрение), так и в результате культуры многолетних трав. При пониженной кислотности для повышения Б. п. необходимо вносить известь.
Ионное произведение воды. Водородный показатель (pH).
В природных и технологических процессах самым распространенным растворителем является вода. Особенностью жидкого состояния воды является способность ее молекул к самопроизвольной диссоциации:
H2O H+ + OH-.
Константа диссоциации
= [H+] [OH−] Kд [H2O] .
Чистая вода практически не проводит электрический ток, степень ее диссоциации очень мала. Поэтому можно считать, что диссоциация не изменяет концентрацию молекул воды. Это позволяет включить [H2O] в константу равновесия. Следовательно, произведение молярных концентраций ионов водорода и гидроксо-ионов – величина постоянная:
Kw = [H+] [OH–] = 1,0 10-14 [(моль/л)2] при Т=298 К.
Эта константа называется ионным произведением воды (KW). Его величина не зависит от концентрации ионов водорода или гидроксо-ионов, поэтому для определения кислотности или щелочности раствора достаточно указать концентрацию одного из ионов. Таким ионом был выбран ион водорода. Если концентрация ионов водорода равна концентрации гидроксоионов, то считается, что среда нейтральная – чистая вода или водные рас-
творы, не содержащие кислот или оснований:
[H+] = [OH–] = 10-7 [моль/л].
Вкислой среде (растворы кислот) концентрация ионов водорода больше концентрации гидроксо-ионов: [H+] > 10-7 моль/л. В щелочной среде
(растворы щелочей) концентрация гидроксо-ионов больше концентрации ионов водорода: [H+] < 10-7 моль/л. Для удобства пользования концентрацию ионов водорода указывают в виде специальной характеристики - водородного показателя. Водородный показатель pH (произносится «пэ
аш») – десятичный логарифм концентрации ионов водорода, взятый с обратным знаком: pH = –lg[H+].
Внейтральной среде pH = 7, в кислой pH < 7, в щелочной pH > 7.
Примечание. Аналогично водородному показателю pH существует показатель pОH = = –lg[ОH–]. Очевидно, что pH+ pОH = 14.
Потенциометрический метод определения pH.
Метод основан на изменении электродвижущей силы (э.д.с.), возникающей при опускании, в раствор двух электродов: измерительного и сравнения. Потенциал электрода сравнения (хлорсеребряного или каломельного) не зависит от величины рН раствора. Потенциал измерительного электрода (платинового или стеклянного) определяется концентрацией ионов водорода в растворе. При измерении рН между мембраной стеклянного электрода и раствором возникает разность потенциалов, по которой определяется рН.
Перед анализом электроды необходимо вымочить в 0,1 М НС1 около 5–7 суток, а перед погружением в суспензию их следует сполоснуть дистиллированной водой. После включения рН-метра в сеть настраивают его по буферным растворам. Порядок работы с прибором изложен в инструкции к прибору. При определении рН в минеральных почвах соотношение почва и раствор (дистиллированная вода или 1 М КС1) берется 1: 2,5, в торфяных почвах и лесных подстилках – 1: 25.

