ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 93
Скачиваний: 3
Кислые почвы характеризуются недостатком Са2+ и отчасти Mg2+, элементов, необходимых для нормального развития растений. В то же время содержание А13+, Мп2+, Н+ часто достигает токсичных для сельскохозяйственных культур концентраций. Особенно велика негативная роль алюминия. Повышенное количество подвижного алюминия в почве приводит к нарушению у растений обмена веществ и отрицательно влияет на формирование генеративных органов.Токсичное действие алюминия сказывается в первую очередь на корневой системе растений. Накопление в корнях алюминия препятствует поглощению и передвижению в растении кальция и фосфора. Корни, испытывающие воздействие токсичных концентраций алюминия, утолщаются и укорачиваются, их рост замедляется, появляются отмершие участки. При содержании подвижного алюминия на уровне 8—10 мг/100 г почвы урожай таких культур, как кукуруза, ячмень, яровая пшеница, лен-долгунец, может погибнуть полностью. Близкие эффекты при низких значениях pH оказывает на растения и марганец.
Кислая среда угнетающе действует на микроорганизмы осуществляющие аммонификацию, нитрификацию и фиксацию азота из воздуха, поскольку оптимум pH для их развития находится в пределах 6,5—8,0. В результате этого ухудшается азотный режим почвы.
В кислых почвах складывается неблагоприятный фосфатный режим, что обусловлено связыванием фосфора соединениями железа и алюминия, в результате чего он переходит в труднодоступное для растений состояние.
При подкислении почв существенно возрастает растворимость и подвижность бора, меди, цинка, кобальта и других микроэлементов.
Избыточное количество их подвижных форм оказывает токсичное действие на растения. В то же время высокая кислотность снижает доступность растениям такого важного микроэлемента, как молибден.
В кислой среде ухудшаются условия гумусообразования, что ведет к преимущественному накоплению фульвокислот и низкомолекулярных органических соединений, менее ценных с агрономической точки зрения, чем гуминовые кислоты. Низкое содержание и неблагоприятный состав гумуса наряду с дефицитом кальция обусловливают неудовлетворительные физические свойства кислых почв. Они часто переуплотнены, плохо оструктурены, склонны к коркообра- зованию, что неблагоприятно отражается на их водно-воздушном режиме.
Эффективное использование сильнокислых и кислых почв возможно только после проведения химической мелиорации. Широко распространенным приемом повышения их плодородия служит известкование, устраняющее избыточную кислотность и способствующее насыщению ППК кальцием. При внесении в почву извести (СаС03) она реагирует с углекислотой почвенного раствора и переходит в гидрокарбонат кальция, который взаимодействует с почвой.
-
Почвенная кислотность, формы, способы регулирования.
Кислотность почвы— способность почвы подкислять воду и растворы нейтральных солей.
Кислотность водного раствора, в том числе почвенного, определяется соотношением ионов Н+.
При разложении органических остатков образуется много органических кислот, которые при определенных условиях нейтрализуются не полностью и поэтому почвы приобретают кислую реакцию. Первоисточником кислотности любой почвы являются водородные ионы угольной, и особенно органических, кислот, образующихся при разложении органических остатков и выделяемых корнями растений. Реакцию почвенного раствора выражают величиной рН, представляющей собой отрицательный логарифм концентрации водородных ионов в растворе. почвы могут иметь нейтральную (рН 7), кислую (рН менее 7) или щелочную (рН более 7) реакцию.
Кислотность делится на: актуальную (активную) и потенциальную (скрытую), которая, в свою очередь, подразделяется на обменную и гидролитическую.
Актуальная кислотность – кислотность почвенного раствора, обусловленная повышенной концентрацией ионов водорода по сравнению с ионами гидроксила. Она определяется наличием в нем водорастворимых кислот – щавелевой, лимонной, фульвокислот, гидролитических кислых солей, а прежде всего угольной кислоты (Н2СО3). Для большинства почв реация почвенного раствора рН колеблется от 4до 8. В дерново-подзолистых и торфяно-болотных почвах она находится в пределах 4,0-5,5.
Актуальная кислотность имеет большое значение в жизни растений и микроорганизмов.
Потенциальная кислотность – кислотность твердой фазы почвы. Она обусловлена наличием ионов водорода и алюминия в ППК в поглощенном состоянии. Подразделяется на два вида: обменную и гидролитическую
Обменная кислотность обусловлена наличием в поглощенном состоянии ионов водорода и алюминия, способных обмениваться на катионы нейтральных солей, например хлорида калия. Обменная кислотность- это кислотность, обусловленная обменно-поглощенными ионами водорода и алюминия, которые извлекаются из почвы при ее обработке раствором нейтральной соли. В величину обменной кислотности входит и актуальная кислотность. Следовательно, обменная кислотность всегда больше, чем актуальная, а рН солевой вытяжки ниже рН водной.
Обменная кислотность наиболее ярко выражена в подзолистых и красноземных почвах (рН 3-4). Для пахотного слоя дерново-подзолистых почв рН солевой вытяжки колеблется от 4 до 6, а в хорошо окультуренных почвах повышается до 6,0-6,5.
У почв с повышенной обменной кислотностью неблагоприятные агрономические свойства, которые могут быть улучшены известкованием и внесением достаточного количества органических удобрений
Гидролитическая кислотность (Hr) определяется наличием в почве поглощенных ионов водорода и алюминия, способных обмениваться на катионы гидролитически щелочных солей. Эта кислотность обнаруживается в растворе после обработки почвы уксуснокислым натрием и включающая все содержащиеся в почве ионы водорода - не только легко подвижные, но и менее подвижные, способные к замене на основания лишь при щелочной реакции среды.
Гидролитическая кислотность является первой формой кислотности, появляющейся при обеднении почвы основаниями. В дерново-подзолистых почвах ее уровень может быть значительным при сильно выраженной обменной кислотности, и в этих почвах она характеризует насыщенность почв основаниями.
Реакция почвенного раствора может изменяться вследствие накопления кислых продуктов разложения органических остатков, под влиянием выделения корнями растений углекислоты и Н-ионов, образования азотной кислоты при нитрифицирующей деятельности микроорганизмов.
Реакция почвенной среды может существенно измениться при внесении физиологически кислых или физиологически щелочных минеральных удобрений. При этом изменение реакции на разных почвах будет неодинаково. На одних действие подкисляющих или подщелачивающих веществ будет проявляться больше, на других меньше вследствие разной буферной способности почв.
-
Почвенная щелочность, формы, способы регулирования.
Щелочная реакция почвенных растворов и водных вытяжек обуславливается наличием повышенной концентрации в почве ионов гидрооксила ОН-. Различают актуальную и потенциальную щелочность.
Актуальная щелочность обусловлена наличием в почвенном растворе гидролитически щелочных солей: карбонатов и гидрокарбонатов калия и натрия, кальция и магния (Na2CO3 , NaHCO3, Актуальная щелочность выражается величиной рН.
При характеристике актуальной щелочности природных вод и почвенных растворов различают общую щелочность, щелочность от нормальных карбонатов и щелочность от гидрокарбонатов. Эти виды щелочности различаются по граничным значениям рН. Щелочность от нормальных карбонатов является результатом обменных реакций почв, содержащих поглощенный натрий.
Потенциальная щелочность обусловлена наличием в почве поглощенного натрия и проявляется при взаимодействии с угольной кислотой. Потенциальная щелочность дает представление о суммарном содержании щелочей в почвенном растворе.
Щелочная реакция неблагоприятна для большинства растений, а почвы приобретают неблагоприятные физические и химические свойства. При рН 9-10 они отличаются твердостью в сухом, вязкостью и липкостью во влажном состоянии. Щелочность почв характерна для солонцов, каштановых почв, сероземов, засоленных почв. Устраняют щелочность гипсованием, которое проводится при содержании более 10% поглощенного натрия от емкости катионного обмена.
Избыточную щелочность устраняют гипсованием почвы:
-
Вследствие изменения реакции почвенного раствора после известкования и гипсования почв урожай сельскохозяйственных культур значительно повышается.
-
Норму гипса определяют в зависимости от содержания в почве обменного натрия.
-
Понятие о буферности почв.
Буферной способностью, или буферностью, называют способность почвы противостоять изменению реакции почвенного раствора.
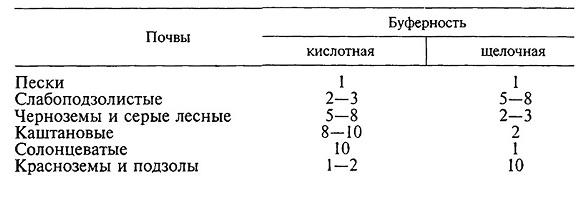
Различают буферную способность почв против изменения реакции в сторону подкисления и буферную способность против изменения реакции в сторону подщелачивания. Буферность зависит от химического состава и емкости поглощения почвы, состава поглощенных катионов и свойств почвенного раствора.


