Файл: Отчет по лабораторной работе 12 По дисциплине Физика.docx
Добавлен: 19.03.2024
Просмотров: 53
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО НАУКИ И высшего ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей и технической физики
Отчет по лабораторной работе №12
По дисциплине: Физика
(наименование учебной дисциплины согласно учебному плану)
Тема: Исследование эффекта Джоуля-Томсона при адиабатическом истечении газа
Выполнил: / /
(подпись) (Ф.И.О.)
Проверил: _ _ / /
(должность) (подпись) (Ф.И.О.)
Оценка:
Дата:
Санкт-Петербург
2022 год
Цель работы:
Определение изменения температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры; вычислить коэффициенты Ван-дер-Ваальса a и b по результатам эксперимента.
Краткое теоретическое содержание:
Явление, изучаемое в работе – эффект Джоуля-Томсона при адиабатическом истечении углекислого газа. Сущность явления: изменение температуры газа при адиабатическом расширении газа без совершения им полезной работы.
Реальным называется газ, между молекулами которого действуют силы межмолекулярного взаимодействия, состоящие из сил притяжения и сил отталкивания.
Уравнение Ван-дер-Ваальса описывает газообразное состояние и переход к жидкому и твердому состоянию. Формула устанавливает зависимость между давлением, молярным объёмом и абсолютной температурой реального газа при помощи коэффициентов Ван-дер-Ваальса и имеет вид:

Поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь).
Поправка b — поправка, учитывающая силы отталкивания (из общего объёма вычитается объём, занимаемый молекулами).
Уравнение Ван-дер-Ваальса можно применять для качественных оценок изменений агрегатного состояние вещества. Экспериментальные изотермы состояния газа отличаются тем, что участок теоретической зависимости, где давление растет с увеличением объема, представляет собой горизонтальный участок, соответствующий сжижению газа, которое при заданной температуре происходит при постоянном давлении.
При повышении температуры этот участок уменьшается и превращается в точку. Эта точка называется критической. Значения давления, объема и температуры в этой точке называются критическими параметрами.
В случае медленно протекающего адиабатического расширения (расширении газа без теплообмена с окружающей средой) реального газа при изменении давления происходит изменение температуры. Это явление получило название эффекта Джоуля-Томсона.
Схема установки:
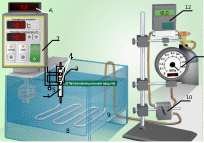 Основным элементом установки является трубка 1 с пористой перегородкой 2, через которую пропускается исследуемый газ. Пористая перегородка 2 расположена в конце трубки и представляет собой стеклянную пористую пробку со множеством узких и длинных каналов. Температура воды измеряется термопарой 5 и отображается на индикаторе 7, разность температур до и после перегородки измеряется дифференциальной термопарой 4 и отображается на индикаторе 6. Газ поступает в систему из баллона 13 через редуктор 12, который позволяет регулировать давление газа в магистрали. Кран 10 позволяет перекрыть поток газа, давление контролируется манометром 11. Термостат управляется с пульта 7. Переключатель "ЦИРК" включает или выключает циркуляцию воды через водяную рубашку трубы 3. Индикацией включения циркуляции является вращение крыльчатки насоса внутри термостата.
Основным элементом установки является трубка 1 с пористой перегородкой 2, через которую пропускается исследуемый газ. Пористая перегородка 2 расположена в конце трубки и представляет собой стеклянную пористую пробку со множеством узких и длинных каналов. Температура воды измеряется термопарой 5 и отображается на индикаторе 7, разность температур до и после перегородки измеряется дифференциальной термопарой 4 и отображается на индикаторе 6. Газ поступает в систему из баллона 13 через редуктор 12, который позволяет регулировать давление газа в магистрали. Кран 10 позволяет перекрыть поток газа, давление контролируется манометром 11. Термостат управляется с пульта 7. Переключатель "ЦИРК" включает или выключает циркуляцию воды через водяную рубашку трубы 3. Индикацией включения циркуляции является вращение крыльчатки насоса внутри термостата.Расчётные формулы:
1.Перепад давлений в теплоизолированной трубке:
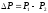 ,
,где
 - разность давлений,
- разность давлений, 
= Па;
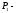 начальное давление,
начальное давление, 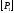 = Па;
= Па; 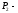 атмосферное давление
атмосферное давление 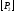 = Па.
= Па.2.Коэффициент Джоуля-Томсона:
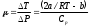 ,
,где
 коэффициент Джоуля -Томсона,
коэффициент Джоуля -Томсона,  =
= ;
; - разность температур,
- разность температур,  =
=  ;
; - постоянная Ван-дер-Ваальса,
- постоянная Ван-дер-Ваальса, 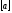 =
= 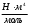 ;
; - универсальная газовая постоянная, R= 8,31
- универсальная газовая постоянная, R= 8,31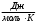 ;
;  - температура газа,
- температура газа, 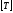 = К;
= К;  - постоянная Ван-дер-Ваальса,
- постоянная Ван-дер-Ваальса,  =
=  ;
;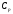 - теплоёмкость при постоянном давлении,
- теплоёмкость при постоянном давлении, 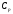 = 41
= 41 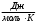 .
.3.Температура инверсии:
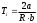 ,
,где
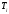 - температура инверсии,
- температура инверсии, 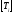 =
= 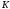 ;
; 
- постоянная Ван-дер-Ваальса,
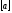 =
= 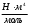 ;
; - универсальная газовая постоянная, R= 8,31
- универсальная газовая постоянная, R= 8,31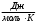 ;
; - постоянная Ван-дер-Ваальса,
- постоянная Ван-дер-Ваальса,  =
=  ;
;4.Температура критическая:
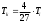 ,
,где
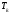 - температура критическая.
- температура критическая.Формулы косвенных погрешностей:
1.Абсолютная погрешность измерений коэффициента Джоуля-Томсона:
 ,
,где
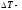 средняя арифметическая ошибка.
средняя арифметическая ошибка.  = К;
= К;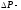 приборная погрешность барометра,
приборная погрешность барометра,  = Па;
= Па;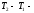 результат изменения температур,
результат изменения температур,  = К;
= К;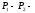 результат изменения давлений,
результат изменения давлений,  = Па;
= Па; коэффициент Джоуля -Томсона,
коэффициент Джоуля -Томсона,  =
=  .
.2.Абсолютная погрешность измерений температуры инверсии:
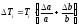 ,
,где
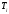 - температура инверсии,
- температура инверсии, 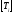 =
= 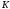 .
. погрешность измерения коэффициента
погрешность измерения коэффициента  ,
, 
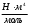 ;
;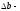 погрешность измерения коэффициента b, =
погрешность измерения коэффициента b, = ;
; - постоянная Ван-дер-Ваальса,
- постоянная Ван-дер-Ваальса, 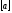 =
= 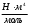 ;
; - постоянная Ван-дер-Ваальса,
- постоянная Ван-дер-Ваальса,  =
=  .
.3.Абсолютная погрешность измерения температуры критической:
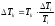 ,
,где
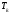 - температура критическая;
- температура критическая;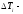 абсолютная погрешность измерений температуры инверсии;
абсолютная погрешность измерений температуры инверсии;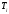 - температура инверсии,
- температура инверсии, 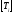 =
= 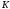 .
.Таблица 1. Результаты измерений
| Физ. величина | T | P | T | | a | b | Тинв | Ткр |
 Ед.изм. № опыта | 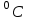 | 105 Па | 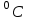 | 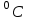 /Па /Па | 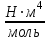 | 10¯⁵ 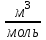 | К | К |
| 1 | 20 | 10 | 11 | 1,10 | 0,910 | 29,79 | 735,2 | 108,9 |
| 2 | 20 | 9 | 9,87 | 1,10 | ||||
| 3 | 20 | 8 | 8,74 | 1,09 | ||||
| 4 | 20 | 7,5 | 8,18 | 1,09 | ||||
| 5 | 20 | 7 | 7,63 | 1,09 | ||||
| 6 | 20 | 6,5 | 7,07 | 1,09 | ||||
| 7 | 20 | 6 | 6,52 | 1,09 | ||||
| 8 | 20 | 5,5 | 5,96 | 1,08 | ||||
| 9 | 45 | 10 | 9,55 | 0,96 | ||||
| 10 | 45 | 9,5 | 9,07 | 0,955 | ||||
| 11 | 45 | 9 | 8,58 | 0,953 | ||||
| 12 | 45 | 8,5 | 8,1 | 0,953 | ||||
| 13 | 45 | 8 | 7,61 | 0,951 | ||||
| 14 | 45 | 7,5 | 7,13 | 0,832 | ||||
| 15 | 45 | 7 | 6,65 | 0,950 | ||||
| 16 | 75 | 9,5 | 7,91 | 0,83 | ||||
| 17 | 75 | 9 | 7,49 | 0,83 | ||||
| 18 | 75 | 8,5 | 7,07 | 0,832 | ||||
| 19 | 75 | 8 | 6,65 | 0,83 | ||||
| 20 | 75 | 7,5 | 6,24 | 0,83 |


