Файл: Инструкция Вам предлагаются задания с одним правильным ответом из пяти предложенных.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.03.2024
Просмотров: 18
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ХИМИЯ
| Инструкция: «Вам предлагаются задания с одним правильным ответом из пяти предложенных». 1. К важнейшим восстановителям относятся: A) перманганат калия, манганат калия и хромат калия B) серная кислота, сульфат натрия и оксид серы (IV) C) вода, царская водка и олеум D) оксид марганца (IV), оксид углерода (IV) и оксид кремния (IV) E) аммиак, щелочные и щелочно-земельные металлы |
| 2. Вещество с ковалентной неполярной связью A) AlCl3 B) O3 C) Ag D) HF E) H2O |
| 3. При нагревании пищевой соды образуется газ A) CO B) O2 C) CO2 D) N2 E) H2 |
| 4. Не относится к свойствам угольной кислоты A) слабая B) окрашенная C) двухосновная D) растворимая E) неустойчивая |
| 5. Вещество, с которым не реагирует бутадиен-1,3 A) хлороводород B) бром C) кислород D) метан E) водород |
| 6. Твердое мыло имеет формулу A)  B)  C)  D)  E) 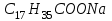 |
| 7. Соотношение масс ионов в нитрате меди (II) A) 8 : 31 B) 8 : 23 C) 16 : 35 D) 32 : 31 E) 16 : 31 |
| 8. В 200 мл 0,5М раствора, ортофосфорной кислоты содержится 0,09 г катионов водорода (при полной диссоциации). Степень диссоциации кислоты A) 15% B) 10% C) 30% D) 4% E) 8% |
| 9. При электролизе раствора, содержащего сульфат двухвалентного металла, образовалось 32 г металла и 5,6 л газа. Этот металл A) Ag B) Hg C) Ni D) Cu E) Fe |
| 10. Аммиак будет реагировать с A) хлоридом натрия B) фосфином C) гидроксидом бария D) водородом E) азотной кислотой |
| 11. Низшая степень окисления азота в молекуле A) нитрата аммония B) оксида азота (I) C) азотной кислоты D) азота E) оксида азота (II) |
| 12. Молекулярная масса ацетона равна A) 92 B) 30 C) 227 D) 58 E) 108 |
| 13. Жидкость X в реакции с Na выделяет газ, а при дегидратации вещества X образуется только пентен-1. Вещество X A) 2- метилбутанол-2 B) пентанол-1 C) пентанол-2 D) 2- метилбутанол E) изобутанол |
| 14. Масса ортофосфорной кислоты, необходимая для получения 200 г 25%-ного ее раствора, составляет A) 40 г B) 80 г C) 60 г D) 100 г E) 50 г |
| 15. При обработке предельного одноатомного спирта натрием выделилось 2,24 л газа, а при окислении того же количества спирта образовалось 11,6 г альдегида. Формула спирта A) СН3ОН B) С2Н5ОН C) С5Н11ОН D) С3Н7ОН E) С4Н9ОН |
| 16. Объем метана (н.у.), полученного при взаимодействии 41 г ацетата натрия и 12 г гидроксида натрия A) 22,4 л B) 11,2 л C) 6,72 л D) 33,6 л E) 5,6 л |
| 17. В системе А + В = С начальные концентрации [А]=0,7 моль/л, [В]=0,65 моль/л. Если через 10 мин концентрация [А]=0,25 моль/л, то средняя скорость реакции и концентрация вещества [С] A) 0,125 моль/л∙мин; возрастет на 0,25 моль/л B) 0,105 моль/л∙мин; возрастет на 0,15 моль/л C) 0,045 моль/л∙мин; возрастет на 0,45 моль/л D) 0,045 моль/л∙мин; уменьшится на 0,45 моль/л E) 0,025 моль/л∙мин; возрастет на 0,25 моль/л |
| 18. Число вакантных 3d-орбиталей в пятивалентном состоянии атома хлора: A) 5 B) 2 C) 1 D) 3 E) 4 |
| 19. Ряд, в котором вещества расположены в порядке увеличения массовой доли азота A) 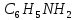 ; ;  ; ;  ; ; 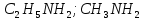 B)  ; ; 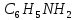 ; ;  ; ;  ; ; 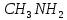 C)  ; ;  ; ; 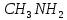 ; ; 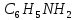 ; ;  D) 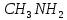 ; ;  ; ;  ; ; 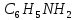 ; ;  E)  ; ; 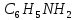 ; ; 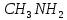 ; ;  ; ;  |
| 20. 12 г водорода прореагировало с нитрометаном. Масса полученного при этом метиламина, с учетом 15% практических потерь, будет равна (в г) A) 52,7 B) 48,9 C) 43,5 D) 43,8 E) 62,0 |
| |
| |
| Инструкция: «Вам предлагаются тестовые задания с одним или с несколькими правильными ответами». 21. Инертный газ A) аргон B) хлор C) бром D) фтор E) водород F) азот G) кислород H) ксенон |
| 22. Признаками химической реакции являются A) появление запаха B) выделение газа при сливании растворов C) диффузия D) образование кристаллов при охлаждении раствора E) образование осадка при сливании растворов F) изменение агрегатного состояния G) исчезновение вещества при растворении H) исчезновение кристаллов при нагревании раствора |
| 23. Физические свойства кислорода A) голубой газ B) без вкуса C) хорошо растворим в воде D) легче воздуха E) малорастворим в воде F) бесцветные кристаллы G) тяжелее воздуха H) бесцветная жидкость |
| 24. Металлы главных подгрупп A) рубидий B) серебро C) магний D) хром E) медь F) железо G) алюминий H) марганец |
| 25. Дисахариды A) дезоксирибоза B) целлюлоза C) глюкоза D) крахмал E) мальтоза F) сахароза G) лактоза H) фруктоза |
| 26. Растительными жирами являются A) льняное масло B) бараний жир C) подсолнечное масло D) машинное масло E) сливочное масло F) рыбий жир G) оливковое масло H) говяжий жир |
| 27. Вещества с ковалентной полярной связью A) железо B) сероводород C) поваренная соль D) медный купорос E) вода F) кислород G) известняк H) хлороводород |
| 28. d- элементами являются A) титан B) сера C) германий D) бор E) алюминий F) ванадий G) хром H) хлор |
| 29. Качественная реакция на ионы серебра (+) происходит с A) 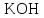 B)  C) 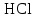 D)  E) 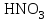 F) CsI G)  H)  |
| 30. Природные соединения кальция A) галит B) флюорит C) асбест D) гипс E) карналит F) мирабилит G) сильвинит H) мрамор |
| 31. Наличие в растворе ионов Cu2+ и SO42- можно определить с помощью реактивов A) 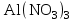 B) 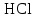 C) 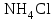 D)  E) 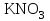 F) 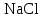 G) 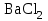 H) 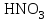 |
| 32. Для осуществления данного превращения СН4 → C2H2 → CH3COH → CH3COOH → CH3COONa необходима следующая последовательность добавления реагентов A) t =1500°C, H2O, Cu(OH)2, NaOH B) t =1500°C, H2O, C2H5OH, NaHCO3 C) t =1000°C, H2O, Ag2O, Na D) t =1500°C, H2O, CuOH, Na2O E) t=1000°C, H2O, Cu(OH)2, NaCl F) t =1500°C, H2O, Ag, Na2O G) t =1000°C, H2O, O2, C2H5ONa H) t =1500°C, H2O, Ag2O, Na2CO3 |
| 33. В схеме превращений 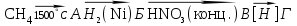 неизвестными веществами А, Б, В, Г являются неизвестными веществами А, Б, В, Г являютсяA) C2H4, C2H6, C2H5NO2, C2H5NH2 B) C2H2, C2H4, C2H5NH2, N2 C) C, CH4, CH3NO2, CH3NH2 D) C2H2, C2H4, C2H5NO3, C2H5NH2 E) C, C2H6, C2H5NO2, C2H5NH2 F) C, CH4, CH3NO2, (CH3)2NH G) C2H2, C2H6, C2H5NO2, C2H5NO H) C2H2, C2H6, C2H5NO2, C2H5NH2 |
| 34. Смесь натрия и калия массой 8,5 г обработали водой. Объем выделившегося водорода (н.у.), если масса натрия 4,6 г A) 3,36 л B) 4,48 л C) 11,2 л D) 22,4 л E) 33,6 л F) 2,24 л G) 1,12 л H) 5,6 л |
| 35. Средняя молекулярная масса и степень полимеризации одинаковы у полимеров A) полипропилен B) ДНК C) полистирол D) полиэтилен E) полиметилметакрилат F) РНК G) белок H) тефлон |
| 36. При повышении температуры на 50°С скорость химической реакции возрастает в 243 раза. Температурный коэффициент равен A) 3 B) 1 C) 6 D) 7 E) 8 F) 2 G) 4 H) 5 |
| 37. Равные массовые доли углерода в соединениях A)  B) 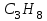 C) 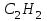 D) 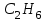 E)  F) 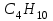 G)  H)  |
| 38. Среда и количество вещества соли, полученная при смешивании 0,5 моль гидроксида натрия и 0,6 моль соляной кислоты, будет A) слабокислой B) 0,5 моль C) щелочной D) кислой E) 0,4 моль F) слабощелочной G) 0,2 моль H) нейтральной |
| 39. В схеме превращений: CH3 –CH3 → A → B→ C → D → E → NH2–CH2–COOH неизвестными веществами A, B, C, D, E могут быть A) бромэтан, этиловый спирт,этаналь, фторуксусная кислота, уксусная кислота B) ацетилен, ацетальдегид, этилен, уксусная кислота, хлоруксусная кислота C) этилен, этанол, уксусный альдегид, уксусная кислота, этиламин D) этилен, ацетилен, ацетальдегид, уксусная кислота, хлоруксусная кислота E) бромэтан, этанол, уксусная кислота,хлоруксусная кислота, фторуксусная кислота F) этилен, этиловый спирт, уксусный альдегид, уксусная кислота, диэтиламин G) этилен, этиловый спирт, ацетальдегид, уксусная кислота, хлоруксусная кислота H) метан, ацетилен, ацетальдегид, уксусная кислота, фторуксусная кислота |
| 40. Смесь цинка и меди массой 25,8 г обработали раствором соляной кислоты.При этом выделилось 4,48 л газа (н.у.). Масса меди A) 4,80 г B) 12,8 г C) 13,0 г D) 2,58 г E) 7,80 г F) 21,0 г G) 15,3 г H) 10,5 г |


