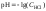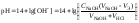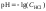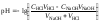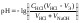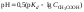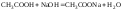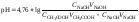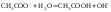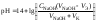ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 45
Скачиваний: 0
СОДЕРЖАНИЕ
Кривая титрования сильной кислоты щёлочью
Кривая титрования сильного основания кислотой
Кривая титрования слабой одноосновной кислоты щёлочью
Кривая титрования слабого однокислотного основания сильной кислотой
Кривая титрования слабой многоосновной кислоты
Кислотно-основное титрование
Аналитическая реакция – нейтрализация кислоты щёлочью или, наоборот, щёлочи кислотой. Эквивалентную точку определяют обычно с помощью цветных индикаторов.
Действие индикаторов
Индикаторами являются слабые органические кислоты или основания, у которых ионная и молекулярная формы имеют различную окраску. Например, фенолфталеин содержит фенольную функциональную группу, метилоранж – ароматическая сульфокислота с функциональной группой SO3H. Процесс их диссоциации в общем виде можно представить уравнением:
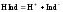 .
.
Константа диссоциации индикатора определяется уравнением:
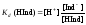 .
.
Концентрации ионной и молекулярной форм в середине области перехода окраски индикатора равны между собой и рН перехода окраски индикатора равен логарифму константы диссоциации:
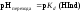 .
.
При
 цвет раствора будет обусловлен окраской
ионной формы индикатора и, наоборот,
при
цвет раствора будет обусловлен окраской
ионной формы индикатора и, наоборот,
при
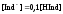 раствор будет окрашен молекулярной
формой индикатора. Поэтому переход
окраски происходит в области
раствор будет окрашен молекулярной
формой индикатора. Поэтому переход
окраски происходит в области
 .
.
Фенолфталеин является очень слабой кислотой, поэтому он изменяет окраску от бесцветной к малиновой в слабощелочной области, при рН = 8,3 – 10. Метиловый оранжевый – кислота средней силы, изменяет окраску от красной к жёлтой в слабокислой области при рН = 3,7 – 5,1. Лакмус изменяет окраску от красной к синей в нейтральной области при рН около 7.
Кривые титрования
Кривые титрования – графические зависимости концентрации участника реакции, протекающей при титровании от объёма добавленного титранта. Для реакций кислотно-основного взаимодействия показателем концентрации участника реакции является рН раствора.
Различают теоретические и экспериментальные кривые титрования. Теоретический расчёт кривых титрования проводится по уравнению реакции и исходным концентрациям реагирующих веществ. Теоретические кривые титрования нужны для обоснованного выбора индикатора в данном титровании. Экспериментальные кривые титрования получают при измерении какого-либо свойства системы в ходе титрования (ЭДС, электропроводность и т.п.) в зависимости от объёма титранта. Экспериментальные кривые титрования нужны для определения точки эквивалентности.
Кривые кислотно-основного титрования позволяют проследить за качественными и количественными изменениями титруемого раствора и выбрать наиболее подходящий индикатор для определения точки эквивалентности (конца титрования).
При построении теоретических кривых титрования рассчитывают рН четырёх основных этапов:
1) до начала титрования;
2) титрование до точки эквивалентности;
3) точка эквивалентности;
4) после точки эквивалентности.
Кривая титрования сильной кислоты щёлочью
Аналитическая реакция – реакция нейтрализации
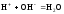 .
.
1 этап. В растворе присутствует только сильная кислота, рН раствора определяется её концентрацией:
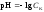 ,
,
где СK – нормальная концентрация кислоты.
2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью:
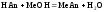 .
.
рН вычисляется по уравнению:
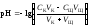 ,
,
где VK – объём пробы кислоты, взятый для титрования (аликвота), СЩ – нормальная концентрация раствора щёлочи, VЩ – объём раствора щёлочи, добавленного в процессе титрования.
3 этап. Точка эквивалентности. В системе находится только негидролизующаяся соль. рН = 7. На нейтрализацию кислоты затрачен эквивалентный объём щелочи VЭ.
4 этап. Добавление избытка титранта после точки эквивалентности. рН определяется только количеством добавленной щёлочи и вычисляется по уравнению:
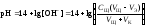 .
.
Пример. Рассчитать кривую титрования 10 мл 0,1 н. соляной кислоты 0,1 н. раствором гидроксида натрия.
|
VNaOH, мл |
Система |
Расчётная формула |
рН |
|
0 |
0,1 н. раствор HCl |
|
1,00 |
|
1 |
Титрование соляной кислоты. |
|
1,09 |
|
5 |
1,48 |
||
|
7 |
1,75 |
||
|
9 |
2,28 |
||
|
9,5 |
2,59 |
||
|
9,9 |
3,30 |
||
|
10 |
NaCl |
Точка эквивалентности, VЭ = 10 мл, VΣ = 20 мл |
7,00 |
|
10,1 |
Избыток щёлочи |
|
10,70 |
|
11 |
11,68 |
||
|
12 |
11,96 |
||
|
15 |
12,30 |
||
|
20 |
12,52 |
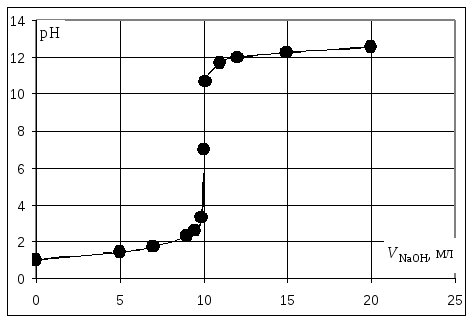
Кривая титрования сильной кислоты щелочью
Точка эквивалентности соответствует объёму титранта 10 мл. Обращает внимание резкий скачок величины рН в этой области. Объём одной капли раствора обычно составляет 0,01-0,02 мл. В области эквивалентной точки при добавлении капли щёлочи рН возрастает на 3-6 единиц. Поэтому эквивалентную точку можно определить с помощью любого цветного индикатора, изменяющего окраску в области значений рН от 4 до 10.
Кривая титрования сильного основания кислотой
Аналитическая реакция – реакция нейтрализации
 .
.
1 этап. В растворе присутствует только щёлочь и рН раствора определяется её концентрацией:
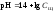 .
.
2 этап. Процесс титрования. Происходит постепенная нейтрализация щелочи кислотой:
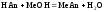 .
.
рН вычисляется по уравнению:
 .
.
3 этап. Точка эквивалентности. В системе находится только негидролизующаяся соль. рН = 7. На нейтрализацию кислоты затрачен эквивалентный объём кислоты VЭ.
4 этап. После точки эквивалентности рН определяется только количеством добавленной кислоты и вычисляется по уравнению:
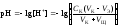 .
.
Пример. Рассчитать кривую титрования 10 мл 0,1 н. гидроксида натрия 0,1 н. раствором соляной кислоты.
|
VNaOH, мл |
Система |
Расчётная формула |
рН |
|
0 |
0,1 н. раствор NaOH |
|
13,00 |
|
1 |
Титрование гидроксида натрия. |
|
12,91 |
|
5 |
12,52 |
||
|
7 |
12,25 |
||
|
9 |
11,72 |
||
|
9,5 |
11,41 |
||
|
9,9 |
10,70 |
||
|
10 |
NaCl |
Точка эквивалентности, VЭ = 10 мл, VΣ = 20 мл |
7,00 |
|
10,1 |
Избыток кислоты |
|
3,30 |
|
11 |
2,32 |
||
|
12 |
2,04 |
||
|
15 |
1,70 |
||
|
20 |
1,48 |
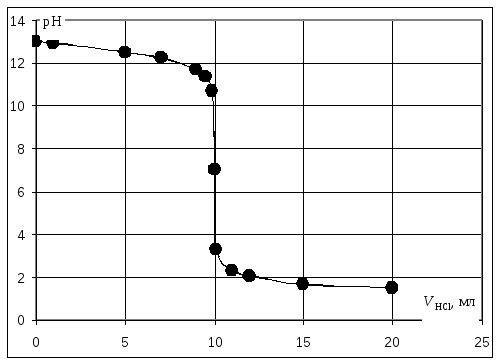
Кривая титрования сильного основания кислотой
Кривая титрования щёлочи кислотой является зеркальным отражением кривой титрования сильной кислоты щёлочью. Эквивалентную точку можно определить с помощью любого цветного индикатора, изменяющего окраску в области значений рН от 4 до 10.
Кривая титрования слабой одноосновной кислоты щёлочью
1 этап. В растворе присутствует только слабая кислота и рН раствора определяется её концентрацией и константой диссоциации:
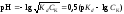 .
.
где СK – концентрация раствора кислоты, моль/л.
2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью:
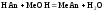 .
.
В результате образуется буферная смесь, состоящая из слабой кислоты, избыток которой присутствует в системе до точки эквивалентности и соли этой кислоты. рН вычисляется по уравнению для кислого буферного раствора:
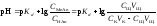 ,
,
где
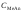 – концентрация соли слабой кислоты,
– концентрация соли слабой кислоты,
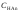 – остаточная концентрация слабой
кислоты, VK –
объём пробы кислоты, взятый для
титрования, СЩ – концентрация
раствора щёлочи, VЩ
– объём раствора щёлочи, добавленный
в процессе титрования.
– остаточная концентрация слабой
кислоты, VK –
объём пробы кислоты, взятый для
титрования, СЩ – концентрация
раствора щёлочи, VЩ
– объём раствора щёлочи, добавленный
в процессе титрования.
3 этап. Точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объём щёлочи VЭ. В системе находится только соль, гидролизующаяся по аниону. рН в точке эквивалентности будет больше 7 и вычисляется по уравнению:
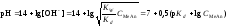 .
.
Концентрация соли в точке эквивалентности:
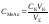 ,
,
где
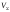 ‒ общий объём раствора в точке
эквивалентности,
‒ общий объём раствора в точке
эквивалентности,
 .
.
4 этап. После точки эквивалентности рН определяется только количеством добавленной щёлочи:
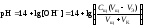 .
.
Пример. Рассчитать кривую титрования 10 мл 0,1 н. уксусной кислоты 0,1 н. раствором гидроксида натрия.
|
VNaOH, мл |
Система |
Расчётная формула |
рН |
|
0 |
0,1 н. раствор СН3СООН |
|
2,88 |
|
1 |
Титрование уксусной кислоты. |
Образование буферного раствора СН3СООН + СН3COONa:
|
3,80 |
|
5 |
4,76 |
||
|
7 |
5,12 |
||
|
9 |
5,71 |
||
|
9,5 |
6,03 |
||
|
9,9 |
6,75 |
||
|
10 |
Точка эквивалентности, VЭ = 10 мл, VΣ = 20 мл. |
Гидролиз соли СН3COONa:
|
8,88 |
|
10,1 |
Избыток щелочи |
|
10,70 |
|
11 |
11,68 |
||
|
12 |
11,96 |
||
|
15 |
12,30 |
||
|
20 |
12,52 |