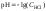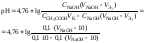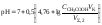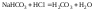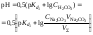ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 50
Скачиваний: 0
СОДЕРЖАНИЕ
Кривая титрования сильной кислоты щёлочью
Кривая титрования сильного основания кислотой
Кривая титрования слабой одноосновной кислоты щёлочью
Кривая титрования слабого однокислотного основания сильной кислотой
Кривая титрования слабой многоосновной кислоты

Кривая титрования ортофосфорной кислоты щёлочью
Следует отметить, что вследствие малой константы диссоциации кислоты по третьей ступени, на кривой титрования ортофосфорной кислоты можно выделить только 2 скачка значений рН, соответствующих двум эквивалентным точкам. Первую из них при рН около 4,7 удобно определять с помощью индикатора бромкрезолового зелёного по переходу окраски из жёлтой в голубую, вторую эквивалентную точку при рН в районе 9,6 можно определить с тимоловым голубым.
Кривая титрования смеси сильной и слабой кислот
Раздельное титрование смеси кислот (оснований) в воде возможно, если
= отношение их констант диссоциации не менее 104;
= константы диссоциации титруемых кислот (оснований) не менее 10‒7;
=
соблюдается условие:
 для достижения погрешности не более
1 %.
для достижения погрешности не более
1 %.
При этом сначала титруется более сильная кислота, а затем – более слабая.
На кривой титрования будет наблюдаться соответствующее число скачков титрования. При соотношении констант диссоциации меньше 104 на кривой титрования получится один скачок, соответствующий суммарному титрованию кислот (оснований).
Кривая титрования получается совмещением соответствующих участков кривых титрования сильной и слабой кислот. Первый участок соответствует титрованию сильной кислоты. Поэтому в первой эквивалентной точке рН раствора определяется присутствием слабой кислоты. Далее кривая титрования аналогична таковой для слабой кислоты. Вторая эквивалентная точка соответствует содержанию в системе соли, гидролизующейся по аниону.
В качестве примера рассмотрим титрование аликвоты объёмом 10 мл, содержащей 0,1 М соляную и 0,1 М уксусную кислоты, 0,1 н. раствором гидроксида натрия.
1. До начала титрования рН раствора в основном определяется концентрацией в растворе соляной кислоты.
2. При расчёте первого участка кривой титрования следует учесть вклад слабой кислоты в концентрацию ионов Н+, который значителен вблизи первой эквивалентной точки и приводит к её сдвигу от значения рН=7 в кислую область. Формулу для расчёта концентрации ионов Н+ получим из условия баланса зарядов, пренебрегая вкладом в него ионов гидроксила, который мал в кислой среде:
 .
.
В этом уравнении произведём следующие подстановки:
 ,
,
 ,
,
 .
.
В итоге получим уравнение для расчёта концентрации катионов водорода в зависимости от объёма добавленной щёлочи:
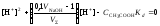 ,
,
 .
.
3. В первой точке эквивалентности рН раствора определяется концентрацией уксусной кислоты и её константой диссоциации:
 .
.
4. При расчёте второго участка кривой титрования следует учесть образование ацетатного буферного раствора:
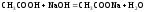 ,
,
для которого
 .
.
5. рН второй точки эквивалентности определяется концентрацией ацетата натрия:
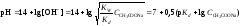 .
.
6. рН третьего участка кривой титрования определяется количеством щёлочи:
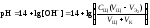 .
.
Расчёт кривой титрования 10 мл раствора 0,1 н. соляной и 0,1 н. уксусной кислот щёлочью:
|
VNaOH, мл |
Система |
Расчётная формула |
рН |
|
0 |
HCl и CH3COOH |
|
1 |
|
5 |
Титрование соляной кислоты. Присутствует CH3COOH |
|
1,48 |
|
7 |
1,75 |
||
|
9 |
2,25 |
||
|
10 |
Первая точка эквивалентности. VЭ,1 = 10 мл, VΣ1 = 20 мл |
CH3COOH
|
3,03 |
|
11 |
Титрование уксусной кислоты. |
Образование буферного раствора: СН3СООН-СН3COONa
|
3,81 |
|
12 |
4,16 |
||
|
15 |
4,76 |
||
|
17 |
5,13 |
||
|
19 |
5,71 |
||
|
19,5 |
6,04 |
||
|
19,9 |
6,76 |
||
|
20 |
Вторая точка эквивалентности, VЭ,2 = 20 мл, VΣ,2 = 30 мл |
Гидролиз соли СН3COONa
|
10,12 |
|
21 |
Избыток щёлочи |
|
11,51 |
|
22 |
11,80 |
||
|
25 |
12,15 |
||
|
30 |
12,40 |
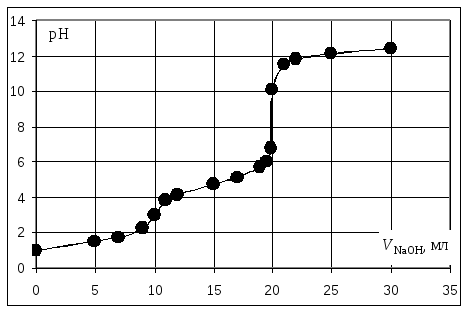
Кривая титрования смеси соляной и уксусной кислот гидроксидом натрия
Первой точке эквивалентности, соответствующей содержанию в пробе сильной кислоты, в рассматриваемом примере отвечает слабый скачок значений рН, который можно зафиксировать с помощью рН-метра или, менее точно, по жёлтому окрашиванию динитрофенола. Если вторая кислота слабее уксусной, например, фенол с Kd = 1010, то первая точка эквивалентности будет выражена резче, но слабее проявится вторая эквивалентная точка.
Кривая титрования раствора соли слабого электролита
Рассмотрим в качестве примера кривую титрования раствора соды. Так как ионы слабой угольной кислоты связывают катионы Н+, карбонатные растворы можно титровать кислотами. Нейтрализация протекает в две ступени, соответственно, на кривой титрования выделяют две эквивалентные точки. Результаты расчёта титрования аликвоты объёмом 10 мл 0,1 M раствора соды 0,1 M соляной кислотой приведены ниже.
Расчёт кривой титрования 10 мл 0,1 М раствора карбоната натрия 0,1 н. соляной кислотой:
|
VNaOH, мл |
Система |
Расчётная формула |
рН |
|
0 |
Гидролизующаяся соль Na2CO3 |
|
11,66 |
|
VNaOH, мл |
Система |
Расчётная формула |
рН |
|
2 |
Титрование соды по первой ступени. |
Буферный раствор H2CO3 + NaHCO3
|
10,93 |
|
5 |
10,33 |
||
|
7 |
9,96 |
||
|
9 |
9,38 |
||
|
9,5 |
9,05 |
||
|
10 |
Первая точка эквивалентности VЭ,1 = 10 мл, VΣ1 = 20 мл |
Гидролиз NaHCO3
|
8,34 |
|
11 |
Титрование соды по второй ступени. |
Буферный раствор NaHCO3 + Na2CO3
|
7,30 |
|
12 |
6,95 |
||
|
15 |
6,35 |
||
|
17 |
5,98 |
||
|
19 |
5,40 |
||
|
19,5 |
5,07 |
||
|
20 |
Вторая точка эквивалентности VЭ,2 = 20 мл, VΣ,2 = 30 мл |
Раствор Н2CO3
|
3,91 |
|
21 |
Избыток соляной кислоты |
|
2,71 |
|
22 |
2,41 |
||
|
25 |
2,04 |
||
|
27 |
1,91 |
||
|
30 |
1,78 |