Файл: 1 Расчет шихты для выплавки ферросилиция марки фс 65.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 15
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
1 Расчет шихты для выплавки ферросилиция марки ФС 65
1.1 Исходные данные
Состав шихтовых материалов используемых при выплавке ферросилиция приведен в табл. 1.1.
Таблица 1.1 – Химический состав шихтовых материалов
Материал | Содержание, % | ||||||||||
| SiO2 | Fe2O3 | Al2O3 | CaO | MgO | SO3 | Fe | C | Зола | Влага и летучие | Всего | |
| Кварцит мытый | 92,2 | 0,3 | 0,7 | 0,3 | 0,1 | - | - | - | - | 1,6 | 100 |
| Коксик сухой | - | - | - | - | - | - | - | 79,94 | 13,5 | 6,56 | 100 |
| Зола коксика | 48,0 | 20,0 | 25,0 | 5,0 | 1,0 | 1,0 | - | - | - | - | 100 |
| Электродная масса | - | - | - | - | - | - | - | 85,0 | 10,0 | 5,0 | 100 |
| Зола электродной массы | 50,0 | 14,0 | 23,0 | 8,0 | 3,0 | 2,0 | - | - | - | - | 100 |
| Железная стружка | - | - | - | - | - | - | 90,0 | - | - | 10,0 | 100 |
Расчет будем вести на 100 кг кварцита. Распределение оксидов в процессе плавки между сплавом и шлаком представлено в табл.1.2.
Таблица 1.2 – Распределение оксидов в процессе плавки
| Восстанавливаемые оксиды | Количество, % | Невосстанавливаемые оксиды, участвующие в формировании шлака | Количество, % |
| SiO2→Si SiO2→SiO | 91 7 | SiO2 | 2 |
| Fe2O3→Fe | 99 | Fe2O3→FeO | 1 |
| Al2O3→Al | 50 | Al2O3 | 50 |
| CaO→Ca | 40 | CaO | 60 |
| MgO→Mg | 0 | MgO | 100 |
| SO3 →S | 100 | SO3 | 0 |
-
-
-
1.2 Расчет количества восстановителя-
1.2.1 Расход углерода для восстановления компонентов кварцита
-
В качестве восстановителя в процессе плавки расходуется углерод коксика и электродной массы. В расчете принимаем, что восстановление оксидов идет по реакциям:
SiO2+2C= Si+2CO (1.1)
SiO2+C= SiO + CO (1.2)
Fe2O3+3C=2Fe+3CO (1.3)
CaO+C= Ca+CO (1.4)
Al2O3+3C= 2Al+3CO (1.5)
В ходе указанных выше реакций происходит не только восстановление оксидов, но и выделение кислорода. Расчеты по определению количества восстановленных оксидов и выделившегося при этом кислорода приведены в табл.1.3.
Количество кислорода, высвобождаемого при восстановлении части Fe2O3 до Fe в табл.1.3 не учтено из-за его малой величины. Действительно, количество Fe2O3, восстанавливающегося до FeO равно 0,3·0,01=0,003 кг. При этом высвобождается кислорода0,003·16/160=0,0003 кг. Все величины в табл. 1.3 определены с точностью до третьего знака после запятой. В приведенном же расчете полученная величина на порядок меньше и ею можно пренебречь.
Таблица 1.3. – Количество восстановленных оксидов и выделившегося кислорода из 100 кг кварцита
| Оксид | Восстанавливается оксида, кг | Выделяется кислорода, кг |
| SiO2→Si | 92,8·0,91=84,448 | 84,448·32/60=45,038 |
| SiO2→SiO | 92,8·0,07=6,496 | 6,496·16/60=1,732 |
| Fe2O3→Fe | 0,3·0,99=0,297 | 0,297·48/160=0,089 |
| Al2O3→Al | 0,7·0,5=0,350 | 0,350·48/102=0,165 |
| CaO→Ca | 0,3·0,4=0,120 | 0,120·16/56=0,034 |
| Итого | | 47,058 |
При определении количества восстановленных оксидов использовались данные химического состава кварцита (табл. 1.1, 1.2). Например, вычисляя количество восстановленного SiO2 до Si, учитываем, что кварцит содержит 97 % SiO2 и только 91 % его восстанавливается до Si. Составляя пропорцию
92,8 кг SiO2 – 100 %
x кг SiO2 – 91 %,
вычисляем, что количество SiO2, восстановленного до Si равно
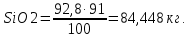
Аналогично определяется количество других восстановленных оксидов.
При определении количества выделившегося кислорода использовали уравнения реакций (1.1-1.5). Например, из уравнения реакции (1.1) следует, что при восстановлении 60 кг SiO2 выделяется 32 кг O2 в виде двух молекул СО, а при восстановлении 84,4480 кг SiO2 выделяется неизвестное количество кислорода, которое необходимо определить
SiO2+2C= Si+2CO
60 кг SiO2 – 32 кг O2
84,448 кг SiO2 – х кг O2.
Тогда
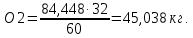
По аналогии вычисляется количество кислорода, выделившегося при окислении других оксидов и определяется общее его количество, которое составляет 47,159 кг (см. табл. 1.3).
Дальнейшая задача заключается в определении количества углерода, необходимого для связывания указанного выше количества кислорода:
С+ ½ О2=СО
12 кг С – 16 кг О2
x кг С – 47,159 кг О2
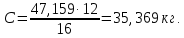
Таким образом, для восстановления всех компонентов, содержащихся в 100 кг кварцита, требуется
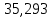 6 кг.
6 кг.-
1.2.2 Определение восстановительной способности коксика
Поскольку углерод коксика расходуется не только на восстановление оксидов кварцита, но и на восстановление компонентов золы, содержащейся в коксике, необходимо определить восстановительную способность коксика (количество углерода, оставшееся в коксике после восстановления компонентов его золы). Она рассчитывается с учетом потребности углерода на восстановление оксидов золы коксика. Обычно в коксике содержится 9,3-15,5 % золы [2]. В данном примере расчета принят коксик с содержанием 10 % золы (см. табл. 1.1). Расчет восстановления золы коксика сведен в табл.1.4.
Таблица 1.4 – Количество восстановленных оксидов и выделившегося кислорода из 10 кг золы кокса
| Оксид | Восстанавливается оксида, кг | Выделяется кислорода, кг |
| SiO2→Si | 13,5·0,48·0,91= 5,896 | 5,896·32/60=3,144 |
| SiO2→SiO | 13,5·0,48·0,07=0,453 | 0,453·16/60=0,121 |
| Fe2O3→Fe | 13,5·0,20·0,99=2,673 | 2,673·48/160=0,802 |
| Al2O3→Al | 13,5·0,25·0,50=1,687 | 1,687·48/102=0,793 |
| CaO→Ca | 13,5·0,05·0,40=0,270 | 0,270·16/56=0,077 |
| SO3 →S | 13,5·0,01·1,0= 0,135 | 0,135·48/80=0,081 |
| Итого | | 5,018 |
При составлении табл. 1.4. используются данные химического состава золы коксика (см. табл. 1.1.) с учетом восстанавливаемых из нее оксидов (см. табл. 1.2).
Для связывания 5,018 кг кислорода требуется углерода
5,018·12/16 = 3,763 кг.
Восстановительная способность коксика составляет
85-3,763= 81,237 %.
Таким образом, из имеющегося в коксике углерода (85 %), на восстановление оксидов кварцита расходуется 81,237%, а на восстановление оксидов золы коксика – 3,763 %.
-
1.2.3 Участие углерода электродной массы
в восстановительных процессах
Расход электродной массы на 1 т кварцита по практическим данным составляет 15-20 кг [3]. Принимаем расход электродной массы равным 17 кг/т или 1,7 кг/100 кг кварцита. В электродной массе также, как и в коксике содержится зола, количество которой составляет 10 % (см. табл. 1.1).
Расчеты по определению количества восстанавливаемых оксидов из золы электродной массы и выделяющегося при этом кислорода приведены в табл. 1.5. При заполнении таблицы используются данные химического состава золы электродной массы (см. табл. 1.1) с учетом количества восстанавливаемых оксидов (см. табл. 1.2).
Таблица 1.5 – Количество восстановленных оксидов и выделившегося
кислорода из золы электродной массы
| Оксид | Восстанавливается оксида из золы электродной массы, кг | Выделяется кислорода, кг |
| SiO2→Si | 1,7·0,10·0,5·0,91=0,077 | 0,077·32/60=0,041 |
| SiO2→SiO | 1,7·0,10·0,5·0,07=0,006 | 0,006·16/60=0,002 |
| Fe2O3→Fe | 1,7·0,10·0,14·0,99=0,024 | 0,024·48/160= 0,007 |
| Al2O3→Al | 1,7·0,10·0,23·0,50=0,020 | 0,020·48/102=0,009 |
| CaO→Ca | 1,7·0,10·0,08·0,4=0,005 | 0,005·16/56=0,001 |
| SO3 →S | 1,7·0,10·0,02·1=0,003 | 0,003·48/80=0,002 |
| Итого | | 0,062 |
Для связывания 0,062 кг кислорода требуется углерода:
0,062·12/16= 0,046 кг.
Электродная масса вносит углерода:
1,7·85/100= 1,445 кг.
Принимаем, что половина этого углерода сгорает в кислороде воздуха, а другая – участвует в восстановлении оксидов. Принимаем, что сгорает и участвует в восстановлении оксидов примерно одинаковое количество углерода электродной массы, т.е.
1,445/2= 0,722 кг.
Из 0,722 кг углерода, участвующего в восстановительных процессах, на восстановление золы электродной массы тратится 0,046 кг. Остаток углерода будет израсходован на восстановление кварцита.
0,722-0,046=0,676 кг.
-
Расход коксика
Ранее было определено (см. п. 1.2.1 ), что для восстановления всех компонентов кварцита требуется 36,876 кг углерода. Известно также, что 0,676 кг углерода на восстановление кварцита вносит электродная масса. Тогда за счет коксика должно быть внесено углерода
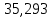 -0,676= 35,247 кг.
-0,676= 35,247 кг.Этому количеству углерода соответствует следующее количество коксика:
35,247·100/81,237= 43,387 кг.
На колошнике печи часть коксика (8-10%) сгорает [3]. С учетом угара коксика на колошнике печи в количестве 8 % расход коксика на 100 кг кварцита составит
43,387·100/92= 47,159 кг.
-
1.3 Расчет расхода железной стружки
Для определения расхода железной стружки необходимо знать марку и массу сплава. Для этого рассчитываем количество восстановленных элементов из кварцита, золы коксика и золы электродной массы с учетом потерь этих элементов. Расчет количества восстановленных элементов приведен в табл. 1.6, исходные данные для которой взяты из табл.1.3, 1.4 и 1.5, а также результат расчета расхода коксика, полученный в разделе 1.6.
В ходе плавки часть элементов теряется за счет их улета в рабочее пространство. Величина улета для различных элементов составляет [3]: Fe=5-7%, Al=10-15 %, Ca=10-15 %, S=100 %. Кремний уносится только в составе монооксида кремния SiO. Принимаем величину улета для Fe= 5 %, Al= 15 %, Ca= 15 %, S= 100 %.
Таблица 1.6 – Количество восстановленных элементов
| Элемент | Восстанавливается из кварцита, кг | Восстанавливается из золы коксика, кг | Восстанавливается из золы электродной массы, кг | Всего, кг |
| Si | 84,448- 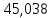 =39,41 =39,41 | (5,896-2,33)·0,4715=1,681 | 0,077-0,041= 0,036 | 41,127 |
| Al | 0,35-0,165=0,185 | (1,250-0,588)·0,4715= 0,312 | 0,020-0,009=0,010 | 0,507 |
| Fe | 0,297-0,089=0,208 | (1,980-0,594)·0,4715= 0,653 | 0,024-0,007=0,016 | 0,877 |
| Ca | 0,120-0,034=0,086 | (0,200-0,057)·0,4715= 0,067 | 0,005-0,002=0,004 | 0,157 |
| S | - | (0,10-0,06)·0,4715= 0,0188 | 0,003-0,002=0,001 | 0,020 |


