Файл: Лабораторная работа Тема Определение скорости химических процессов. Цель работы.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.03.2024
Просмотров: 6
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Лабораторная работа № 1. Тема: Определение скорости химических процессов. Цель работы:
-
Познакомиться с закономерностями протекания химических процессов; -
Научиться экспериментально определять скорость химических реакций; -
Определить влияние концентрации исходных веществ на скорость химической реакции; -
Использовать закон действующих масс для расчета скорости химических процессов.
Реактивы и оборудование:
-
Растворы тиосульфата натрия (Na2S2O3) различной концентрации – 0,2 М; 0,3 М; 0,5 М; 1,0 М (М – означает молярность или молярная
концентрация раствора);
-
Раствор серной кислоты (H2SO4) с массовым соотношением 1:200; -
Химическая посуда; -
Секундомер; -
Черный экран.
Ход опыта:
В качестве изучаемой реакции выбрана реакция взаимодействия
тиосульфата натрия (Na2S2O3) с серной кислотой (H2SO4). Уравнение реакции имеет следующий вид:
Na2S2O3 + H2SO4 → Na2SO4 +H2O+SO2+S↓
Задание 1. Внести полученные данные в таблицу 1.
Таблица 1. Время протекание и скорость химической реакции.
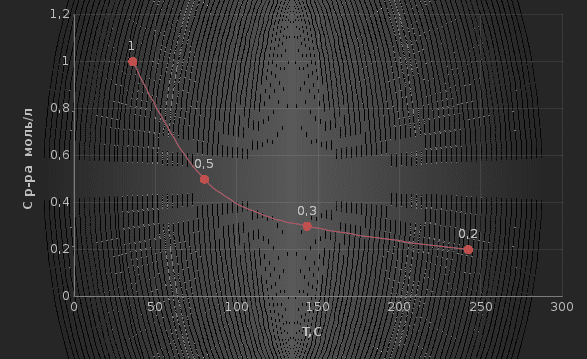
| Концентрация раствора Na2S2O3 C, моль/л | Время протекания реакции t, c | Мгновенная скорость химической реакции Vмгнов, моль/л*с |
| 0,2 | 242 | 0,0059 |
| 0,3 | 143 | |
| 0,5 | 80 | |
| 1,0 | 36 |
График зависимости времени реакции от концентрации раствора, на котором представлена касательная, угол наклона, точки пересечения с осями
координат.
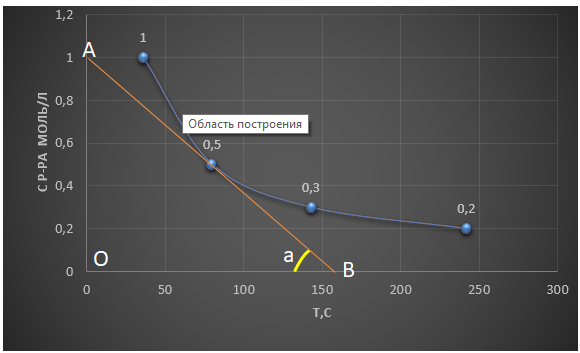 Расчет значения мгновенной скорости реакции:
Расчет значения мгновенной скорости реакции: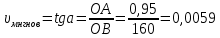
Выражение закона действующих масс для изучаемой реакции Na2S2O3+H2SO4→Na2SO4+H2O+SO2↑+S↓:
ᵞпр.р. = k · [Na2S2O3] · [H2SO4]
Вывод: чем больше концентрация исходного вещества (Na2S2O3), тем быстрее появляется осадок серы, то есть тем выше скорость химической реакции. Таким образом, скорость химической реакции в каждый момент времени прямо пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам.


