Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 137
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
46.Двухатомные частицы О2, [ О2]- , [ О2]+ , [ О2]-2.

Энергетическая диаграмма молекулы О2.

Энергетическая диаграмма молекулы [ О2]-

Энергетическая диаграмма молекулы [ О2]+
Старые Ответы на экзаменационные вопросы по общей химии
1. Основные понятия и определения; Атом. Молекула. Химический элемент.
Простые и сложные вещества. Масса атомов и молекул. Химические явления ,
смеси. Аллотропия.
]Изотопы. Моль. Валентность, степень окисления. Молярная масса.
Химия - это наука о веществах и законах, по которым происходят их превращения в другие вещества.
Атомно- молекулярное учение – это учение о строении вещества из атомов и молекул, основными положениями которого являются:
1.Вещества состоят из молекул. Молекула- это наименьшая частица вещества, которая сохраняет его химические свойства.
2. Молекулы состоят из атомов. Атом – это наименьшая частица химического элемента. которая сохраняет его химические свойства.
3.Вещества, молекулы которых состоят из атомов одного элемента, называются простыми веществами. Вещества, молекулы которых состоят из атомов разных элементов, называются сложными веществами.
4. Молекулы и атомы находятся в непрерывном движении. С повышением температуры скорость движения молекул увеличивается. Характер движения частиц зависит от агрегатного состояния вещества ( у твердых веществ – колебательные, у жидких – колебательные и скачкообразные, у газов – хаотичные по всему объему).
5. В результате химических реакций молекулы одних веществ превращаются в молекулы других веществ.
С точки зрения атомно-молекулярного учения химическим элементом называется каждый отдельный вид атомов. Важнейшей характеристикой атома является положительный заряд ядра, численно равный порядковому номеру элемента.
Химический элемент – это совокупность атомов с одинаковым положительным зарядом ядра.
Простые вещества – это вещества, состоящие из атомов одного и того же химического элемента.
Сложные вещества – это вещества, состоящие из атомов разных химических элементов.
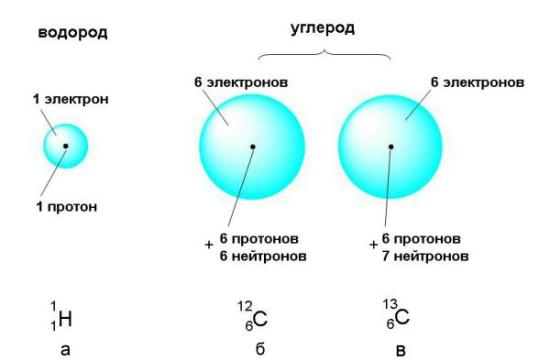
Атом –электронейтральная система взаимодействующих элементарных частиц состоящая из положительного заряда ядра (образованного протонами и нейтронами) и отрицательно заряженных электронов.
Ядро состоит из протонов и нейтронов, вместе называемых нуклонами. Элемент – совокупность атомов с одинаковым зарядом ядра, т.е. числом протонов.
Молекула – это электронейтральная наименьшая совокупность атомов, образующих определенную структуру посредством химических связей.
Существование химического элемента в виде нескольких простых веществ называется аллотропией, различные простые вещества, образованные одним и тем же элементом, называются аллотропическими видоизменениями этого элемента. Явление аллотропии обусловлено в одних случаях тем, что молекулы различных аллотропических видоизменений состоят из различного числа атомов, а в других – тем, что их кристаллы имеют различное строение.
Кислород относится к первой категории аллотропных элементов. Кислород в нормальных условиях – газ без цвета и запаха, озон – газ с характерным резким , но приятным запахом.
Примером вторых являются аллотропные модификации углерода С – алмаз и графит
Атом может потерять один или несколько электронов или наоборот – захватить чужые электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом.
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Масса нейтрона практически не отличается от массы протона. Вместе протоны и нейтроны называются нуклонами (от латинского nucleus – ядро).
ЭЛЕМЕНТОМ называется вещество, состоящее из атомов с одинаковым ЗАРЯДОМ ЯДРА.
Сумма тяжелых частиц (нейтронов и протонов) в ядре атома какого-либо элемента называется
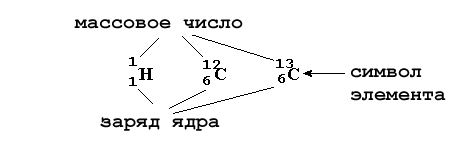
массовым числом и обозначается буквой А. Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента. A = Z + N
Здесь A – массовое число атома (сумма протонов и нейтронов), Z – заряд ядра (число протонов в ядре), N – число нейтронов в ядре.
Природа устроена так, что один и тот же элемент может существовать в виде двух или нескольких изотопов. Изотопы отличаются друг от друга только числом нейтронов в ядре (числом N). Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Изотопами называются вещества, состоящие из атомов с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре. Изотопы отличаются друг от друга только массовым числом. Все элементы состоят из одного или нескольких изотопов.
 <="" p="">
<="" p="">Масса атома, выраженная в килограммах или граммах, называется абсолютной атомной массой. Чаще пользуются относительной атомной массой, которая выражается в атомных единицах массы (а.е.м.). Относительная атомная масса представляет собой отношение массы какого-нибудь атома к массе 1/12 части атома углерода. Иногда говорят более коротко: атомный вес. Относительная атомная масса и атомный вес, фактически, безразмерные величины (масса какого-либо атома делится на массу части атома углерода), поэтому обозначение "а.е.м." после численного значения обычно опускают . Термины “относительная атомная масса”, “атомная масса”, “атомный вес” в научном химическом языке обычно используются равноправно и между ними просто не делают различий.
Относительная атомная масса (Аr) – это число, которое показывает, во сколько раз масса данного атома больше 1\12 части массы атома углерода.
Аr = mа/ 1/12 mа (с),
где mа- масса атома данного элемента,
mа (с) – масса атома углерода.
Относительная молекулярная масса вещества – это число, которое показывает, во сколько раз масса молекулы этого вещества больше атомной единицы массы.
Мr == mв-ва/ 1/12 mа (с)
mа- масса молекулы данного элемента,
mа (с) – масса атома углерода.
Поскольку масса любой молекулы равна сумме масс составляющих ее атомов, то относительная молекулярная масса равна сумме соответствующих атомных масс.
Мr(СО2) = Аr(С) + 2 Аr(О) = 12 + 2. 16 = 44
Моль- это количество вещества, которое содержит столько структурных единиц, сколько атомов содержится в 12 г изотопа углерода- 12.
Число Авогадро ΝА= 6,02х10 23 моль-1
один моль любого вещества содержит 6,02х10 23 моль-1 молекул или атомов.
Масса одного моля вещества называется молярной массой, обозначается символом М и выражается в кг\моль или г\моль.
Молярная масса равна отношению массы вещества к его количеству. М= m/n n = m/М
Валентность – это способность атомов элементов образовывать определенное число химических связей.
Валентность определяется числом связей, которые образует данный атом с другими атомами в молекуле.
Степень окисления- это условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов.
Степень окисления – электрический заряд, который возник бы на атоме, если бы электронные пары которыми он связан с другими атомами в соединении, перешли к более электроотрицательным атомам, а электронные пары, принадлежащие одинаковым атомам, были бы между ними поделены.
2.Основные стехиометрические законы: Сохранение веса, постоянства состава, кратных отношений. Эквивалент. Закон эквивалентов. Химические эквиваленты простых и сложных веществ (примеры).
Закона сохранения массы, являющегося следствием всеобщего естественного закона сохранения материи и движения , Впервые этот закон сформулировал М.В. Ломоносов в 1748 г.
Закон сохранения массы веществ: Масса веществ вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения массы является частным случаем общего закона природы- закона сохранения энергии. Его можно сформулировать так:
энергия никуда не исчезает и ниоткуда не берется, а только превращается из одного вида в другой.
Энергия- это мера движения и взаимодействия различных видов материи. Энергия изолированной системы постоянна.
Закон сохранения энергии выражается равенством:
Q =∆U + А
Где Q – теплота, сообщаемая системе (веществу),
∆U – изменение внутренней энергии системы (вещества),
А – работа против всех сил, действующих на систему.
Например: Н2SО4 + 2NаОН = Nа2SО4 +2 Н2О
Закон постоянства состава.
Французский ученый Ж.Пруст в 1808 г. Сформулировал закон постоянства состава:
Каждое чистое вещество имеет качественный постоянный и количественный состав, который не зависит от способа получения вещества.
Закон постоянства состава вещества справедлив только для веществ молекулярного строения.
Например: Н2SО4 + 2NаС1 = Nа2SО4 +2 НС1
Н2SО4 + 2NаОН = Nа2SО4 +2 Н2О
Закон кратных отношений ( Дж. Дальтон, 1803 г.)
Если два элемента могут образовывать между собой несколько соединений, то массовые доли любого из элементов в этих соединениях относятся друг к другу как небольшие целые числа.
СО, СО2.N2О, N2О3, NО2
W = Аr /Мr 100%
Закон Эквивалентов (Рихтер 1801 г)
Эквивалентом элемента называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Масса 1 эквивалента элемента называется его эквивалентной массой.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или вообще с одним эквивалентом любого другого вещества *.
законом эквивалентов.
Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. m1 / m2= Э1/Э2
Э = А/В простого вещества Эса=40/2=20
Эоксида = М / n В n – число атомов элемента Э(Nа2О)= 23.2+16/ 1.2=31
В - валентность элемента
Эоснования = М / кислотность – число гидроксильных групп Э (Са(ОН)2)= 40+(16+1).2/ 2=37
Экислоты = М / основность – число атомов водорода Э (Н

