Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 120
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
8.История развития строения атома. Радиоактивность.α-β- γ- излучения.
Модель Томсона. Опыты Резерфорда по рассеиванию α- частиц. Модель атома по Э.Резерфорду ее недостатки.
9.Теория атома водорода по Бору (постулаты Бора). Закон и уравнение Планки.
Корпускулярно-волновые свойства электрона. Уравнение де Бройля. Уравнение Шредингера.
Способность неустойчивых ядер самопроизвольно распадаться называются радиоактивностью, а сами неустойчивые атомы – радиоизотопами.
Процессы, в которых атомы одних видов превращаются друг в друга, называются, ядерными реакциями их изучают специальные разделы физики и химии (ядерная физика и ядерная химия).
Процесс радиоактивного распада(Rа) сопровождается выделением энергии в виде потока ά - частиц, β-частиц, γ- излучения.
ά -распад ядро испускает ά -частицу, которое представляет собой ядро атома гелия 42Не, т.е. состоит из 2х протонов и 2х нейтронов.
При ά - это поток положительных заряженных ά – частиц при распаде массовое число атома уменьшается – на 4, а заряд ядра на 2
Например: 22688R→ 22286 Rn +42Не
β-распад. В неустойчивом ядре нейтрон превращается в протон, при этом ядро испускает электрон β-частицу: n→p+е
При β - распаде массовое число изотопа не изменяется т.к. общее число протонов и нейтронов сохраняется, а заряд ядра увеличивается на 1 .
Например: 23490Th→23491Ра + е
Торий протактиний
Т.о. β – излучение – это поток отрицательно заряженных частиц электронов, которое является следствием внутриядерного превращения нейтронов в протоны (n→р + е) в результате чего масса остается без изменения а заряд ядра увеличивается на 1.
γ- излучение – это излучение очень высокой энергии, являющееся следствием перехода атома из одного энергетического состояния в другое, при этом ни массовое число, ни заряд ядра – не изменяются.
открытие рентгеновских лучей Конрадом Рентгеном показало, что атом сложен и состоит из положительных и отрицательных частиц, наименьшую из которых Томсон назвал электроном. Более того, Малликен измерил её заряд е = -1,6×10-19 Кл. и нашел массу электрона m = 9,11×10
-31 кг.
На основании вышеприведенных исследований в 1903 г. Томсон предложил модель атома, которая была названа «пудинг с изюмом», положительный заряд в атоме распределен равномерно с вкрапленным в него отрицательным зарядом. Но дальнейшие исследования показали несостоятельность этой модели.
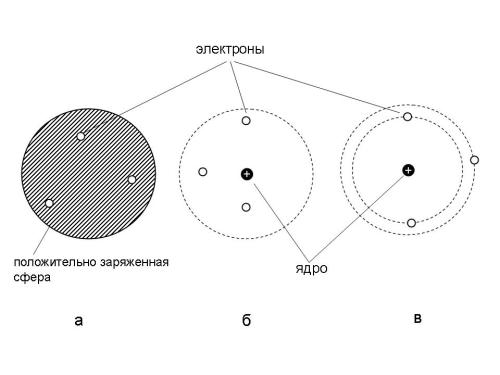
Модели атома: а) Томсона ("сливовый пудинг"),б) Резерфорда ("электронный рой" в пространстве вокруг ядра), в) планетарная
Резерфорд (1910 г.) пропускал через слой вещества (фольга) поток a-лучей и измеряя отклонение отдельных частиц после прохождения через фольгу. Обобщая результаты наблюдений Резерфордом было установлено, что тонкий металлический экран отчасти прозрачен для a-частиц, которые, проходя через листок, либо не изменяли своего пути, либо отклонялись на малые углы. Отдельные же a-частицы отбрасывались назад, как мячик от стены, будто встречали на своем пути непреодолимое препятствие. Так как отбрасывалось назад весьма небольшое число проходящих через фольгу a-частиц, то это препятствие должно занимать в атоме объем, неизмеримо малый даже по сравнению с самим атомом, при этом оно должно обладать большой массой, так как в противном случае a-частицы от него не рикошетировали бы. Таким образом, появилась гипотеза о ядре атома, в котором сосредоточена практически вся масса атома и весь положительный заряд. При этом становятся понятными отклонения пути большинства a-частиц на небольшие углы, под влиянием сил электростатического отталкивания со стороны атомного ядра. В дальнейшем было установлено, что диаметр ядра порядка 10–5 нм, а диаметр атома – 10–1 нм, т.е. объем ядра в 1012 раз меньше объема атома.
В модели атома, предложенной Резерфордом, в центре атома расположено положительно заряженное ядро, а вокруг него движутся электроны, число которых равно величине заряда ядра или порядковому номеру элемента, подобно планетам вокруг Солнца (планетарная модель атома). Развитая Резерфордом ядерная модель была крупным шагом вперед в познании строения атома. Она была подтверждена большим числом экспериментов. Однако в некоторых отношениях модель противоречила твердо установленным фактам. Отметим два таких противоречия.
Во-первых, планетарная модель атома Резерфорда не могла объяснить устойчивости атома. По законам классической электродинамики электрон, двигаясь вокруг ядра, неизбежно теряет энергию. С уменьшением запаса энергии у электрона радиус его орбиты должен непрерывно уменьшаться и в результате упасть на ядро и прекратить свое существование. Физически же атом представляет собой устойчивую систему и может существовать, не разрушаясь, чрезвычайно долго.
Во-вторых, модель Резерфорда приводила к неправильным выводам о характере атомных спектров. Спектры щелочных металлов оказываются сходными со спектром атомарного водорода, и анализ их приводил к заключению о наличие в составе атомов каждого щелочного металла одного электрона, слабо связанного с ядром по сравнению с остальными электронами. Т.е. в атоме электроны размещаются на не одинаковом расстоянии от ядра, а слоями.
Каждый вид атомов характеризуется строго определенным расположением линий в спектре, не повторяющихся у других видов атомов. Именно на этом основан метод спектрального анализа, с помощью которого были открыты многие элементы. Линейчатость атомных спектров противоречила законам классической электродинамики, согласно которой спектр атомов должен быть непрерывным в результате непрерывного излучения электроном энергии.
Модель строения атома водорода Бора. Так как законы классической электродинамики оказались не применимы для описания поведения электрона в атоме, Нильс Бор впервые сформулировал постулаты, основанные на законах квантовой механики.
1) В атоме водорода существуют орбиты, двигаясь по которым, электрон не излучает. Они называются стационарными.
2) Излучение или поглощение энергии происходит в результате перехода электрона с одной стационарной орбиты на другую. Удаленные от ядра орбиты характеризуются большим запасом энергии. При переходе от низших к высшим орбитам атом переходит в возбужденное состояние. Но в этом состоянии он может находиться недолго. Он излучает энергию и возвращается на исходное основное состояние.
При этом энергия кванта излучения равна: hn = En – Ek,
где n и k – целые числа.
3) Электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам. Эти орбиты получили название стационарных .Стационарными являются орбиты, для которых выполняется условие
Планк показал, что изменение энергии происходит не непрерывно (согласно законам классической механики), а скачкообразно, порциями, которые были названы – квантами. Энергия кванта определяется уравнением Планка:
E = hn, где h – постоянная Планка равная 6,63×10–34 Дж×с,
n – частота излучения. Получается, что электрон обладает корпускулярными свойствами (масса, заряд) и Е=mс2 волновыми – частота, длина волны.
В связи с этим Луи де Бройль выдвинул идею о дуализме частиц и волн. Причем корпускулярно-волновой дуализм характерен для всех объектов микро- и макромира, только для макроскопических объектов преобладает один из наборов свойств, и мы говорим о них, как о частицах или волнах, а для элементарных частиц и те, и другие свойства проявляются совместно. Математический дуализм волна-частица выражается уравнением Луи де Бройля:
где λ − длина волны
h – постоянная Планка (6,63·10-34 Дж/с)
m − масса частицы
v − скорость частицы
Уравнение легко выводится, если в уравнение Планка
E = h· υ (υ - частота)
подставить значение E из уравнения Эйнштейна
Е = m ·с2
m · c2 = h · υ
υ = c/ λ
m · c2 = h · с/λ
m · c2 = h /λ
λ = h /m·с,
заменив с – (скорость фотона) на скорость любой микрочастицы v, получим:
λ = h /m · v
Э. Шрёдингер. Он ввел знаменитое уравнение, описывающее поведение электрона в атоме волновой функцией (пси-функция y). Квадрат ее модуля |y|2, вычисленный для определенного момента времени и определенной точки пространства, дает плотность вероятности обнаружения частицы в этой точке в данное время. Функцию y (предложенную Шрёдингером) можно определить путем решения квантово-механического уравнения Шрёдингера. Это уравнение в простейшем случае частицы, движущейся в потенциальном поле, может быть записано в виде:
где m – масса частицы, U – потенциальная энергия, E – полная энергия, x, y, z – декартовы координаты.
Введя, оператор Лапласа, учитывающего распределение волны в трехмерном пространстве:
10.Энергетические уровни в атоме. Электронная структура атома. Строение электронного облака. Понятие об атомных орбиталях. Энергетические диаграммы и электронные конфигурации атомов водорода, гелия, лития, бериллия
11.Квантовые числа: главное(ņ) орбитальное (1), магнитное (m1,) спиновое (mŚ). Заполнение электронами энергетических уровней. Принцип Паули. Правило Гунда. Правило Клечковского.
Главное квантовое число п – характеризует энергию и размеры электронных облаков. Оно принимает значения для основных состояний атомов 1-8 и в принципе до бесконечности. Его физический смысл, как номера энергетического уровня – значение энергии электрона в атоме и как следствие, размер атома.
Побочное, орбитальное (или азимутальное) квантовое число l характеризует форму электронных орбиталей (облаков) вокруг атома и определяет изменение энергии в пределах энергетического уровня, то есть характеризует энергию подуровня. Каждой форме электронного облака соответствует определенное значение механического момента движения электрона, определяемого побочным квантовым числомl, которые изменяется в пределах от 0 до п–1: п=1, l=0; п=2, l=0, l=1; п=3, l=0,l=1, l=2 и т.д.
Те электроны, которые находятся на s уровне называютсяs-электронами, на p уровне p-электронами, на d уровне d-электронами.
Энергия электронов зависит от внешнего магнитного поля. Эта зависимость описывается магнитным квантовым числом. Магнитное квантовое число ml указывает на ориентацию в пространстве электронной орбитали (облако). Внешнее электрическое или магнитное поле изменяет пространственную ориентацию электронных облаков, при этом происходит расщепление энергетических подуровней. Числоml изменяется в пределах от –l, 0, +lи может иметь (2×l+1) значений:
Совокупность трех квантовых чисел однозначно описывает орбиталь. Она обозначается как «квадратик» – . Электрон, как частица, испытывает вращение вокруг собственной оси – по часовой и против часовой стрелки. Оно описывается спиновым квантовым числом s(ms), которое принимает значения ±1/2. Наличие в атоме электронов с противоположно направленными спинами обозначается как «стрелки».
Пространство вокруг ядра, в котором вероятность нахождения е велика, называют – орбиталью.
В многоэлектронных атомах электронное построение в соответствие с набором квантовых чисел регулируется двумя постулатами.
Принцип Паули: В атоме не может быть двух электронов, обладающих 4 одинаковыми квантовыми числами (иначе они не различимы, минимальное энергическое различие в спинах). Следствие, в одной электронной ячейке, орбитали может быть не более двух электронов с разнонаправленными спинами.
Заполнение электронами ячеек осуществляется в соответствии с правилом Гунда. Электроны заполняют s-, p-, d-, f-орбитали таким образом, чтобы суммарный спин был максимальным .
Заполнение электронами подуровней осуществляется в соответствии с правилом Клечковского. Заполнение энергетических уровней происходит в порядке возрастания суммы главного и побочного квантовых чисел n+l.
Если эта сумма имеет одинаковые значения, то заполнение осуществляется в порядке возрастания n. Подуровни заполняются в порядке возрастания энергии:
1s << 2s << 2p << 3s << 3p << 4s £ 3d << 4p << 5s £ 4d << 5p << 6s £ 4f £ 5d…
Энергетические диаграммы и электронные конфигурации атомов водорода, гелия, лития, бериллия
Н Не Li Ве
12.Периодический закон и периодическая система элементов Д.И.Менделеева принцип построения группы, периода. Ś-,р-,đ- f- блоки элементов. Их расположение в периодической системе.Энергетические диаграммы и электронные конфигурации атомов бора, углерода, азота,кислорода,фтора и неона.
13.Важнейшие характеристики элемента: энергия ионизации, относительная электроотрицательность (ОЭО),от каких свойств атомов зависит его ЭО, сродство атома элемента к электрону и их зависимость от радиуса атома. Атомные и ионные радиусы.Показать энергетические диаграммы и электронные конфигурации: атома титана и аниона Тi2+; атома Си и иона Си+.
Д.И.Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Данные о строении ядра и о распределении электронов в атомах позволяют по-новому рассмотреть периодический закон и периодическую систему элементов. На базе современных представлений периодический закон формулируется так:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера)
Горизонтальные строчки Периодической таблицы называются ПЕРИОДАМИ, а вертикальные - ГРУППАМИ.
Номер ПЕРИОДА, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Каждый период Периодической таблицы начинается активным металлом и заканчивается инертным газом.
Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек.
Номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей.
Поэтому номер группы часто совпадает с валентностью элементов.
В этом заключается физический смысл номера группы.
Заряд ядра Z совпадает с ПОРЯДКОВЫМ НОМЕРОМ элемента в Периодической таблице.
Свойства элементов периодически изменяются в соответствии с их атомным весом.
Все элементы разделяются на 4 электронных семейства.
-
s-элементы – это элементы в атомах которых последним заполняется s – подуровень внешнего электронного слоя. Первые два элемента каждого периода. Они составляют главные подгруппы 1 и 2 групп. -
р- элементы – это элементы в атомах которых последним заполняется р –подуровень внешнего электронного слоя. Р – элементы составляют главные подгруппы 3-8 групп. -
d- элементы – это элементы, в атомах которых последним заполняется d- подуровень предвнешнего электронного слоя. Это элементы побочных подгрупп всех восьми групп. -
f- элементы – это элементы в атомах которых последним заполняется f- подуровень третьего снаружи электронного слоя. Это элементы располагающиеся в нижней части периодической системы лантаноиды и актиноиды.
Валентные электроны – это электроны. Которые могут участвовать в образовании химических связей.
В атомах s- и р- элементов валентными являются, все электроны внешнего слоя.
В атомах d – элементов валентными являются электроны s- и d- подуровней.
В атомах f – элементов валентными являются электроны s- и f- подуровней.
Число валентных электронов для большинства элементов равно номеру группы.
Радиус атома- расстояние от ядра атома до максимума электронной плотности его валентных электронов. Чем больше атомный радиус, тем слабее удерживаются внешние электроны. И, наоборот, с уменьшением атомного радиуса электрона притягиваются к ядру сильнее.
Атомы. Лишившиеся одного или нескольких электронов, становятся заряженными положительно, т.к. заряд ядра атома превышает сумму зарядов оставшихся электронов. Атомы, присоединяющие к себе лишние электроны, заряжаются отрицательно. Образующиеся заряженные частицы называются ионами. Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов – к увеличению Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома:
r аниона > r ат.> rкатиона
Энергия ионизации– это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион.
Потенциал ионизации- наименьшее напряжение поля, при котором скорость электронов становится достаточной для ионизации атомов. Выражается в вольтах
Энергия ионизации, выраженная в электронвольтах, численно равна потенциалу ионизации, выраженному в вольтах.
Электроотрицательность характеризует способность атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.
Металличность– это способность атомов элемента отдавать электроны.
Неметалличность– это способность атомов элемента присоединять электроны.
Чем больше металличность, тем меньше ЭО.
Чем больше неметалличность, тем больше ЭО.
Количественной характеристикой неметаличности является сродство к электрону.
Сродство к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому т.е. при превращении атома в отрицательно заряженный ион:
Э0 + е = Э- + Еср.
Чем больше сродство к электрону, тем легче атом присоединяет электрон, тем, сильнее неметаллические свойства элемента.
1. При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
3. СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ - ВОССТАНОВИТЕЛЬНЫЕ свойства элементов.
4.По той же причине, что и окислительные свойства элементов, их ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету.
5. При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
6. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. Это объясняют тем, что электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке (например, у фтора по сравнению с кислородом) не приводит к увеличению размеров атома. Наоборот, размеры атома фтора меньше, чем атома кислорода
7. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
14.Химическая связь. Параметры химической связи: энергия связи, длина связи, валентный угол.виды химической связи, Причины образования химической связи. Зависимость энергии молекулы Н2 от межядерного расстояния
15.Ковалентная связь. Метод валентных связей (МВС). Полярная и неполярная ковалентная связь. Механизмы образования (обменный, донорно-акцепторный)Описание химической связи методом электронных пар.
16.Свойства ковалентной связи: длина, насыщаемость, направленность. Диполь, дипольный момент.
Химической связью называется совокупность взаимодействий ядер и электронов, приводящая к образованию молекул.
Количественные характеристики химической связи.
Химическая связь характеризуется рядом параметров.
Чаще всех основным параметром относят энергию и длину связи.
Если молекула состоит из трех и более атомов, то к этим параметрам добавляют еще и валентный угол.
Энергией связи называют ту энергию, которую необходимо затратить для ее разрыва. При этом молекула должна находится в основном (невозбужденным ) состоянии. Эта величина определяет прочность связи. Чем больше энергии затрачиваемая на разрыв связи, тем прочнее связь.
Единица измерения связи кДж/моль энергия связи в ряду однотипных молекул постепенно изменяется.
Например, энергия связи Н-Г в ряду галогеноводородов НF,HCI,HBr,HI уменьшается ( увеличении радиуса Г) HF=565,7кДж/моль,HI=294,7кДж/моль
Зная энергию связи в молекуле, можно судить о ее реакционной способности и производить термохимические расчеты.
Длиной связи называют среднее расстояние между ядрами, отвечающее минимуму энергии системы.
-
В ряду аналогичных молекул длина связи изменяется закономерно.
Например, в ряду Н-Г длина связи увеличивается сверху вниз (с возрастанием размера атома Г)
-
В молекулах близких по хим. природе в пределах одного гомологического ряда длины связей между ядрами элементов мало различаются (т.е. можно считать постоянными)
Например, длины связей С-С в предельных углеводородах.
-
Кроме того на длину связи влияет ее кратность, которая определяется числом электронных пар, связывающих два атома. С увеличением кратности связей происходит их упрочнение, между ядрами расстояния уменьшаются так, длина связи С-С = 0,154нм;

