Теоретческие основы неорганической химии
Участники и типы окислительно-восстановительных реакций:
Участники и типы окислительно-восстановительных реакций:
Выберите один правильный ответ. Окислители – это:
Вещества, содержащие в своем составе элемент, степень окисления которого в результате реакции понижается
Участники и типы окислительно-восстановительных реакций:
Выберите один правильный ответ. Восстановители – это:
Вещества, содержащие в своем составе элемент, степень окисления которого в результате реакции повышается
Участники и типы окислительно-восстановительных реакций:
Выберите один правильный ответ. Как называются реакции, в которых один и тот же элемент и окисляется, и восстанавливается:
Реакции диспропорционирования
Участники и типы окислительно-восстановительных реакций:
Участники и типы окислительно-восстановительных реакций:
Выберите один правильный ответ. Как называются реакции, в которых одно вещество является окислителем, а другое – восстановителем:
Внутримолекулярные окислительно – восстановительные реакции
Межмолекулярные окислительно – восстановительные реакции
Реакции диспропорционирования
Реакция разложения
Межатомные окислительно – восстановительные реакции
Участники и типы окислительно-восстановительных реакций:
Выберите один правильный ответ. Разложение по схеме 2КСlО3  2КCl + 3О2 является реакцией:
2КCl + 3О2 является реакцией:
Межмолекулярного окисления – восстановления
Внутримолекулярного окисления – восстановления
Диспропорционирования
Диссоциации
Горения
Выберите один правильный ответ. Реакция по уравнению Cl2 + Н2О  НCl + НClО относится к реакциям:
НCl + НClО относится к реакциям:
Межмолекулярного окисления – восстановления
Внутримолекулярного окисления – восстановления
Диспропорционирования
Диссоциации
Гидратации
Химия элементов периодической систем
5 заданий с выбором одного правильного ответа
Жесткость воды и способы ее устранения. Так как кальций широко распространен в природе, его соли в большом количестве содержатся в природных водах. Вода, имеющая в своем составе соли магния и кальция, называется жесткой водой. Если соли присутствуют в воде в небольших количествах или отсутствуют, то вода называется мягкой. В жесткой воде мыло плохо пенится, поскольку соли кальция и магния образуют с ним нерастворимые соединения. В ней плохо развариваются пищевые продукты. При кипячении на стенках паровых котлов образуется накипь, которая плохо проводит теплоту, вызывает увеличение расхода топлива и изнашивание стенок котла.
Жесткость воды подразделяется на:
1) карбонатную жесткость (временную), которая вызывается наличием гидрокарбонатов кальция и магния и устраняется с помощью кипячения;
2) некарбонатную жесткость (постоянную), которая вызывается присутствием в воде сульфитов и хлоридов кальция и магния, которые при кипячении не удаляются, поэтому она называется постоянной жесткостью.
1. Жесткость воды и способы ее устранения. Так как кальций широко распространен в природе, его соли в большом количестве содержатся в природных водах. Вода, имеющая в своем составе соли магния и кальция, называется жесткой водой. Если соли присутствуют в воде в небольших количествах или отсутствуют, то вода называется мягкой. В жесткой воде мыло плохо пенится, поскольку соли кальция и магния образуют с ним нерастворимые соединения. В ней плохо развариваются пищевые продукты. При кипячении на стенках паровых котлов образуется накипь, которая плохо проводит теплоту, вызывает увеличение расхода топлива и изнашивание стенок котла.
Жесткость воды подразделяется на:
1) карбонатную жесткость (временную), которая вызывается наличием гидрокарбонатов кальция и магния и устраняется с помощью кипячения;
2) некарбонатную жесткость (постоянную), которая вызывается присутствием в воде сульфитов и хлоридов кальция и магния, которые при кипячении не удаляются, поэтому она называется постоянной жесткостью.
Устранение постоянной жесткости воды
добавление соды
кипячение
добавление хлорида натрия
добавление щелочи
добавление известкового молока
2. Жесткость воды и способы ее устранения. Так как кальций широко распространен в природе, его соли в большом количестве содержатся в природных водах. Вода, имеющая в своем составе соли магния и кальция, называется жесткой водой. Если соли присутствуют в воде в небольших количествах или отсутствуют, то вода называется мягкой. В жесткой воде мыло плохо пенится, поскольку соли кальция и магния образуют с ним нерастворимые соединения. В ней плохо развариваются пищевые продукты. При кипячении на стенках паровых котлов образуется накипь, которая плохо проводит теплоту, вызывает увеличение расхода топлива и изнашивание стенок котла.
Жесткость воды подразделяется на:
1) карбонатную жесткость (временную), которая вызывается наличием гидрокарбонатов кальция и магния и устраняется с помощью кипячения;
2) некарбонатную жесткость (постоянную), которая вызывается присутствием в воде сульфитов и хлоридов кальция и магния, которые при кипячении не удаляются, поэтому она называется постоянной жесткостью.
Полностью очистить воду от солей можно
добавлением соды
добавлением известкового молока
кипячением
добавлением фосфатов
методом перегонки
3. Жесткость воды и способы ее устранения. Так как кальций широко распространен в природе, его соли в большом количестве содержатся в природных водах. Вода, имеющая в своем составе соли магния и кальция, называется жесткой водой. Если соли присутствуют в воде в небольших количествах или отсутствуют, то вода называется мягкой. В жесткой воде мыло плохо пенится, поскольку соли кальция и магния образуют с ним нерастворимые соединения. В ней плохо развариваются пищевые продукты. При кипячении на стенках паровых котлов образуется накипь, которая плохо проводит теплоту, вызывает увеличение расхода топлива и изнашивание стенок котла.
Жесткость воды подразделяется на:
1) карбонатную жесткость (временную), которая вызывается наличием гидрокарбонатов кальция и магния и устраняется с помощью кипячения;
2) некарбонатную жесткость (постоянную), которая вызывается присутствием в воде сульфитов и хлоридов кальция и магния, которые при кипячении не удаляются, поэтому она называется постоянной жесткостью.
Сумма коэффициентов в уравнении реакции гидрокарбоната кальция и известкового молока
4
5
8
6
7
4. Жесткость воды и способы ее устранения. Так как кальций широко распространен в природе, его соли в большом количестве содержатся в природных водах. Вода, имеющая в своем составе соли магния и кальция, называется жесткой водой. Если соли присутствуют в воде в небольших количествах или отсутствуют, то вода называется мягкой. В жесткой воде мыло плохо пенится, поскольку соли кальция и магния образуют с ним нерастворимые соединения. В ней плохо развариваются пищевые продукты. При кипячении на стенках паровых котлов образуется накипь, которая плохо проводит теплоту, вызывает увеличение расхода топлива и изнашивание стенок котла.
Жесткость воды подразделяется на:
1) карбонатную жесткость (временную), которая вызывается наличием гидрокарбонатов кальция и магния и устраняется с помощью кипячения;
2) некарбонатную жесткость (постоянную), которая вызывается присутствием в воде сульфитов и хлоридов кальция и магния, которые при кипячении не удаляются, поэтому она называется постоянной жесткостью.
При кипячении гидрокарбоната кальция образуются
гидроксид кальция и водород
карбонат кальция, вода и углекислый газ
вода и оксид углерода (IV)
карбонат кальция и вода
водород, кислород и оксид кальция
5. Жесткость воды и способы ее устранения. Так как кальций широко распространен в природе, его соли в большом количестве содержатся в природных водах. Вода, имеющая в своем составе соли магния и кальция, называется жесткой водой. Если соли присутствуют в воде в небольших количествах или отсутствуют, то вода называется мягкой. В жесткой воде мыло плохо пенится, поскольку соли кальция и магния образуют с ним нерастворимые соединения. В ней плохо развариваются пищевые продукты. При кипячении на стенках паровых котлов образуется накипь, которая плохо проводит теплоту, вызывает увеличение расхода топлива и изнашивание стенок котла.
Жесткость воды подразделяется на:
1) карбонатную жесткость (временную), которая вызывается наличием гидрокарбонатов кальция и магния и устраняется с помощью кипячения;
2) некарбонатную жесткость (постоянную), которая вызывается присутствием в воде сульфитов и хлоридов кальция и магния, которые при кипячении не удаляются, поэтому она называется постоянной жесткостью.
Жесткость – это совокупность свойств воды, обусловленных наличием растворимых солей
кальция и магния
калия и магния
натрия и кальция
натрия и калия
калия и кальция
Аналитическая химия
К первой аналитической группе катионов относятся катионы аммония NH4+, калия K+ и натрия Na+. При анализе смеси катионов первой группы сначала определяют и отделяют катион аммония, потом уже катионы натрия и калия. Почему первым определяют катионы аммония?
он улетучивается, а катионы натрия и калия нет
он имеет острый и ядовитый запах
мешает открытию катионов калия и натрия
он реагирует с диоксидом углерода в составе воздуха
он реагирует с кислородом в составе воздуха
Для того, чтобы определить присутствие аммония в часть исследуемого раствора нужно добавить несколько капель определенного реактива, который имеет формулу K2[HgI4]. Если катион аммония присутствует в растворе образуется оскадок красно-бурого цвета. После этого другую часть исследуемого раствора нужно налить в фарфоровую чашку и выпарить до того момента, когда перестанет выделяться белый дым и полностью испарится катион аммония. Как называется следующее соединение: K2[HgI4].?
реактив Селеванова
реактив Грисса
реактив Несслера
реактив Чугаева
реактив Фишера
На дне фарфоровой чашки кристализуются соли катионов калия и натрия. После этого можно проводить качественный анализ следующим катионам. Для того чтобы определить катион калия в часть исследуемого раствора (без катиона аммония) приливают соль гексанитрокобальтата натрия Na3[Co(NO2)6], который в свою очередь, образует осадок.
Осадок какого цвета образуется при определение катиона калия гексанитрокобальтатом натрия Na3[Co(NO2)6]?
синий
красный
желтый
белый
зеленый
В другую часть для определения катиона натрия приливают раствор дигидроантимоната калия KH2SbO4, образуется белый осадок. Для определения катиона нартия используется раствор дигидроантимоната калия KH2SbO4, образуется белый осадок. Какой вид осадка?
студенистый
творожестый
кристалический
в виде клейстера
объемный
Также катионы калия и натрия можно определить на пламени. Для этого нужно в нихромовую проволку положить кристаллы их солей и поднести к пламени.
Как изменится цвет пламени, если над ней сжечь соли катионов калия и натрия?
Na – фиолетовый, К – желтый
Na – оранжевый, К – фиолетовый
Na – желтый, К – фиолетовый
Na – не изменится, К – желтый
Na – фиолетовый, К – не изменится
Ко второй аналитической группе относятся катионы серебра Ag+, ртути (I) [Hg2]2+ и свинца Pb2+. При анализе смеси этих трех катионов используются следующие их соли: AgNO3, Hg2(NO3)2, Pb(NO3)2. Для начала нужно все эти катионы перевести в осадок их групповым реагентом.
Какой раствор является групповым реагентов для катионов ІІ группы ?
HNO3
H2SO4
HCl
H3PO4
NH4OH
После того, как все катионы выпали в осадок, разделяют осадок катиона свинца. Его осадок имеет особенность от осадков ртути и серебра. Какую особенность имеет осадок хлорида свинца PbCl2?
растворяется в растворе разбавленной соляной кислоты
растворяется в холодной воде
растворяется в горячей воде
растворяется в растворе концентрированной соляной кислоты
растворяется в ледяной воде
Дальше проводят качественную реакцию на катион серебра, добавляя к нему раствор йодида калия, в последствии которого образуется осадок. Осадок какого цвета образуется, если к катиону свинца добавить йодид калия?
белый
красный
желтый
кирпично-красный
синий
К осадку, в котором находятся катионы ртути и серебра приливают раствор аммиака, который в свою очередь изменит цвет осадка катиона ртути, а осадок катиона серебра перейдет в раствор. На какой цвет изменится белый осадок ртути, если к нему добавить раствор аммиака?
белый
красный
черный
кирпично-красный
синий
Затем к раствору серебра добавляют определенный раствор, который образует желтый осадок. Какой раствор добавляют к катиону серебра, который дает с ним желтый осадок ?
HCl
H2SO4
KI
H3PO4
NH4OH
контекст
К третьей аналитической группе относятся следующие катионы: Ca2+, Sr2+, Ba2+. Для того, чтобы решить задачу в присутствии смеси солей этих катионов первым определяют катион бария, добавляя к задаче дихромат калия и уксусную кислоту, в следствии образуется осадок.
Осадок какого цвета образуется, если к задаче добавить дихромат калия и уксусную кислоту?
белый
красный
желтый
кирпично-красный
синий
После определения катиона бария его осадок отбрасывают и к центрифугату І, в котором присутствуют катионы кальция Ca2+ и стронция Sr2+ добавляют раствор, который переводит эти катионы в осадок. Какой раствор добавляют к центрифугату І?
HCl
KBr
Na2CO3
Na2SO4
K3PO4
После чего осадок центрифугируют и в осадок ІІ добавляют раствор уксусной кислоты. Осадки растворяются. К полученному раствору добавляют раствор сульфата аммония, который переведет один из катионов в осадок, а другой образует комплексное соединение.
Какой катион выпадает в осадок, если добавить к растворам кальция и стронция сульфат аммония?
Оба
Ca2+
Sr2+
ни один
Ba2+
К раствору комплексной соли кальция добавляют оксалат аммония, при котором образуется осадок оксалата кальция CaC2O4.
Какого цвета осадок оксалата кальция CaC2O4?
желтый
красный
белый
кирпично-красный
синий
Также можно определить осадок кальция окрашиванием цвета пламени. В какой цвет окрасит цвет пламени соли катиона кальция?
желтый
белый
кирпично-красный
зеленый
синий
Методика решения задач по химии
Контекстные
Это одна из важных неорганических кислот, используемых в промышленности. На её основе изготавливаются лакокрасочные изделия, удобрения, взрывчатые вещества и многое другое. При её производстве используется аммиак и кислород воздуха.
Этой кислотой является
HNO2
HNO3
H3BO3
H2SO4
NH4OH
Это одна из важных неорганических кислот, используемых в промышленности. На её основе изготавливаются лакокрасочные изделия, удобрения, взрывчатые вещества и многое другое. При её производстве используется аммиак и кислород воздуха.
Во сколько стадий проходит современное её производство
1
3
2
4
5
Это одна из важных неорганических кислот, используемых в промышленности. На её основе изготавливаются лакокрасочные изделия, удобрения, взрывчатые вещества и многое другое. При её производстве используется аммиак и кислород воздуха.
Для производства 10 кг этой кислоты потребуется аммиака
1 кг
2,7 кг
10 кг
5 кг
7,8
Если в лаборатории щелочь попала на тело или в глаза, то сначала следует быстро промыть холодной водой, а затем обожженные щелочью участки тела промыть 2-процентным раствором уксусной кислоты СН3СООН, а глаза - 2-процентным раствором борной кислоты Н3ВO3. После нейтрализации щелочи снова промыть обожженные участки холодной водой. Для приготовления 500 мл раствора СН3СООН потребуется 70% раствор объёмом
2,82мл
14.29 мл
20,3мл
70,00 мл
45,6 мл
Если в лаборатории щелочь попала на тело или в глаза, то сначала следует быстро промыть холодной водой, а затем обожженные щелочью участки тела промыть 2-процентным раствором уксусной кислоты СН3СООН, а глаза - 2-процентным раствором борной кислоты Н3ВO3. После нейтрализации щелочи снова промыть обожженные участки холодной водой. Для приготовления 500 мл раствора H3BO3 потребуетсяводамассой
10 г
490 г
400 г
50 г
450 г
Химическая экология
Питьевая вода-это вода, в которой бактериологические, органолептические показатели и показатели токсичных химических веществ находятся в пределах норм. Минерализация не более…
не более 1 г/л
не более 2 г/л
не более 3 г/л
не более 4 г/л
не более 5 г/л
Питьевая вода-это вода, в которой бактериологические, органолептические показатели и показатели токсичных химических веществ находятся в пределах норм. Жесткость не должна превышать…
7,0 ммоль/л
8,0 ммоль/л
7,5 ммоь/л
8,5 ммоль/л
7,7 ммоль/л
Питьевая вода-это вода, в которой бактериологические, органолептические показатели и показатели токсичных химических веществ находятся в пределах норм. рН должна быть в пределах…
6,5-9,5
3,5-5,5
4,5-6,0
10,0-10,5
5,5-6,0
Питьевая вода-это вода, в которой бактериологические, органолептические показатели и показатели токсичных химических веществ находятся в пределах норм. Концентрация нитрат-иона не более…
45-50 мг/л
55-58 мг/л
50-58 мг/л
56-60 мг/л
55-60 мг/л
Питьевая вода-это вода, в которой бактериологические, органолептические показатели и показатели токсичных химических веществ находятся в пределах норм. Перманганатная окисляемость не более …
5,0 мг/л
6,0 мг/л
5,5 мг/л
6,5 мг/л
7,0 мг/л
Атмосфера – газовая оболочка Земли. Ее масса составляет около…
5,3-5,9 *1015 тонн
9,0 *1015 тонн
2,5 *1015 тонн
9,0 *1015 л
5,3*1013 кг
Атмосфера – газовая оболочка Земли. Протяженность ее по высоте в средних широтах над уровнем моря составляет..
10-12 км
7-9 км
12-15 км
16-18 км
7-10 км
Атмосфера – газовая оболочка Земли. Протяженность ее по высоте на полюсах составляет…
7-10 км
10-12 км
13-15 км
16-18 км
11-15 км
Атмосфера – газовая оболочка Земли. Протяженность ее по высоте над экватором составляет…
16-18 км
10-12 км
13-15 км
7-10 км
14-15 км
Атмосфера – газовая оболочка Земли. Основные газы атмосферы..
азот, кислород
азот, водород
кислород, водород
кислород, озон
кислород, диоксид углерода
Литосфера. Строение, состав и процессы, происходящие на ее поверхности. По данным А.П. Виноградова в составе земной коры преобладают три элемента:
кислород, кремний, алюминий
кислород, железо, кальций
кислород, натрий, алюминий
кислород, магний, железо
кислород, калий, титан
Литосфера. Строение, состав и процессы, происходящие на ее поверхности. Сколько групп горных пород…
3
4
5
2
7
Литосфера. Строение, состав и процессы, происходящие на ее поверхности. Осадочные породы:
мел, песчаник, известняк
мел, песчаник, базальт
пемза, песчаник, известняк
мел, кварцит, известняк
мел, песчаник, мрамор
Литосфера. Строение, состав и процессы, происходящие на ее поверхности. Какие процессы выветривания:
растворение, гидролиз, гидратация, окисление, дегидратация
пиролиз, гидролиз, гидратация, дегидратация, кристаллизация
нейтрализация, гидролиз, гидратация, окисление, катализ
растворение, гидрирование, гидратация, перекристаллизация, дегидратация
гидрирование, гидролиз, гидратация, дегидрирование
Литосфера. Строение, состав и процессы, происходящие на ее поверхности. К технологическим свойствам почвы относятся:
связанность, пластичность, липкость, физическая спелость почвы
связанность, пластичность, липкость, химическая спелость почвы
связанность, теплопроводность, липкость, рассыпчатость
плавкость, пластичность, липкость, физическая спелость почвы
связанность, пластичность, окисляемость, прочность
Физиология человека и животных
+
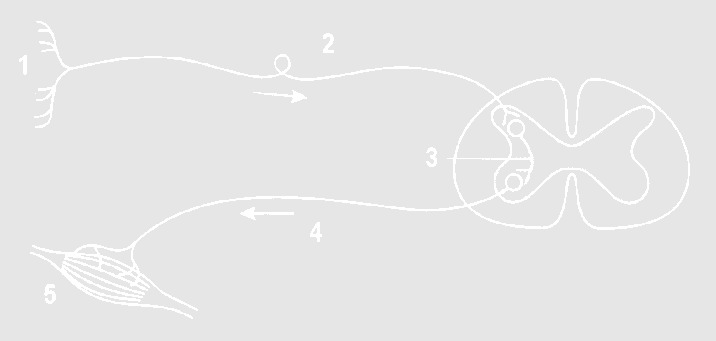
На картинке изображено……?
Рефлекторная дуга;
Нервный импульс;
Мышечная возбудимость.
Строение слухового центра
Строение центра вестибулярного аппарата

Слюноотделение у человека при виде лимона — рефлекс
Условный;
Безусловный;
Защитный.
Ориентировочный
Мембранный
 НCl + НClО относится к реакциям:
НCl + НClО относится к реакциям:



