Файл: Электроотрицательность. Ковалентная полярная связь Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу).docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 25.04.2024
Просмотров: 7
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
| Раздел долгосрочного плана: 8.3В Виды химических связей | Школа: | |||||
| Дата: | ФИО учителя: | |||||
| Класс: 8 | Количество присутствующих: | отсутствующих: | ||||
| Тема урока | Электроотрицательность. Ковалентная полярная связь | |||||
| Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу) | 8.1.4.1 объяснять образование ковалентной связи между атомами на основе электроотрицательности | |||||
| Цели урока |
| |||||
| Критерии оценивания |
| |||||
| Языковые цели | Объяснять/задавать вопросы об электроотрицательности и ковалентной связи Предметная лексика и терминология: устойчивость атома, завершение внешнего энергетического уровня, ковалентная полярная и неполярная связь, общая электронная пара, смещение электронной плотности, неметалл, металл, диаграмма «крестов и точек» | |||||
| Привитие ценностей | Сотрудничество Уважение | |||||
| Межпредметные связи | Физика Математика | |||||
| Предварительные знания | 8.1А Движение электронов в атомах | |||||
| Ход урока | ||||||
| Запланированные этапы урока | Запланированная деятельность на уроке | Ресурсы | ||||
| Начало урока | Приветствие. Проверка домашнего задания (слайд 1) (P) четные пары Раздать учащимся карточки с символами пяти химических элементов третьего периода и предложить расположить их в порядке убывания ЭО элементов нечетные пары Раздать учащимся карточки с символами пяти химических элементов седьмой группы главной подгруппы и предложить расположить их в порядке возрастания ЭО ( проверка: учащиеся соответствующих пар просматривают работы друг друга и устно комментируют, если есть ошибки) - учитель - наблюдатель, готовый прийти на помощь, если будут разногласия (слайд 2) (Т) обращает внимание учащихся на таблицу в учебнике с численными значениями ЭО элементов. Просит найти и сравнить ЭО водорода и серы. Насколько они отличаются? Как вы думаете, как атомы данных элементов будут завершать внешний уровень, чтобы прийти в устойчивое состояние? Отвечая на заданные вопросы, учащиеся выходят на тему урока, цели обучения и критерии оценивания (слайды 3-6) | Презентация Рower Point | ||||
| Середина урока | (T), (W) На примере сероводорода учитель объясняет образование ковалентной полярной связи (слайд 8) H2S ЭО (Н) = 2.1 ЭО (S) = 2.5 ∆ЭО = 0.4 По различию ЭО элементов определяют вид связи: если: 1. Δ ЭО = 0 связь ковалентная неполярная 2. 0 < Δ ЭО < 1.7 связь ковалентная полярная Также связь будет ковалентной полярной, если между собой связаны атомы неметаллов, у которых 1,7 ≤ Δ ЭО ≤ 1.9 У доски учащиеся вместе с учителем разбирают примеры 2,1 4.0 HF ∆ ЭО = 1.9 (водород и фтор неметаллы, значит связь ковалентная полярная, так ЭО фтора выше)  2,1 3.0 HCl ∆ ЭО = 0.9 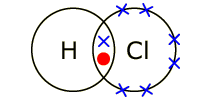 (во время работы можно использовать слайд 9) ∆ ЭО = 1.9 (водород и фтор неметаллы, значит связь ковалентная полярная, так ЭО фтора выше) Для того чтобы сделать вывод, учащиеся подчеркивают правильные ответы в предложениях: 1. Ковалентная связь образуется между атомами металлов/неметаллов. 2. Если Δ ЭО = 0 , то связь ковалентная полярная /ковалентная неполярная связь 3. Если 0 < Δ ЭО < 1.7 связь ковалентная полярная/ковалентная неполярная связь. 4. Если 1,7 ≤ Δ ЭО ≤ 1.9 то между атомами неметаллов образуется ковалентная полярная/ковалентная неполярная связь. Один из учащихся зачитывает свой ответ, если учащиеся не согласны, поднимают красную карточку и аргументируют свой ответ. (І) на заранее приготовленных листках учащиеся пишут диаграммы «крестов и точек» для соединений с ковалентной полярной связью: NH3, Cl2, СH4, H2О, H2, СО2 * Взаимооценивание в паре (слайд 10) - проверка по готовому ответу на доске: три правильных ответа – достиг цели. | | ||||
| Конец урока | В конце урока учащиеся проводят рефлексию: «Шкала успеха» - прямая линия от 0 до 10 баллов Учащимся раздаются стикеры, они подписывают и прикрепляют их на «шкалу успеха», с описанием дальнейших действий для развития. | | ||||
| Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? | Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? | Здоровье и соблюдение техники безопасности | ||||
| | Самооценивание по готовому ответу Устное оценивание с аргументированием ответа Взаимооценивание в паре Обратная связь учителя Формативное оценивание | Время использования интерактивной доски не более 10-15 минут | ||||
| Рефлексия по уроку Были ли цели урока/цели обучения реалистичными? Все ли учащиеся достигли ЦО? Если нет, то почему? Правильно ли проведена дифференциация на уроке? Выдержаны ли были временные этапы урока? Какие отступления были от плана урока и почему? | Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки. | |||||
| | ||||||
| Общая оценка Какие два аспекта урока прошли хорошо (подумайте как о преподавании, так и об обучении)? 1: 2: Что могло бы способствовать улучшению урока (подумайте как о преподавании, так и об обучении)? 1: 2: Что я выявил(а) за время урока о классе или достижениях/трудностях отдельных учеников, на что необходимо обратить внимание на последующих уроках? | ||||||

