Файл: По правилу Клечковского заполнение подуровней происходит в последовательности.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.04.2024
Просмотров: 17
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
в- 1
в+ 2
в- 3
в- 4
Наиболее короткой является связь…
в- K – Cl
в- K – Br
в- K – I
в+ K – F
Валентный угол равен 120˚ в молекуле …
в- CCl 4
в- LiCl
в+ BCl 3
в- MgCl 2
Донором является частица, предоставляющая…
в- электрон
в- пару свободных орбиталей
в- свободную орбиталь
в+ электронную пару
Соответствие формулы соединения и вида химической связи:
С1 KCl
О1 ионная
С2 H2
О2 ковалентная неполярная
С3 HCl
О3 ковалентная полярная
С4 Zn
О4 металлическая
Наиболее прочная связь между элементами в молекуле, формула которой…
в- H2S
в- H2Se
в+ H2O
в- H2Te
Энтальпией образования вещества называется тепловой эффект…
в- реакции образования этого вещества
в- образования сложного вещества из простых веществ
в+ образования 1 моль сложного вещества из простых веществ, устойчивых при стандартных условиях
в- образования сложного вещества из простых веществ, устойчивых при обычных условиях
Реакции, протекающие с выделением теплоты, называются…
в- эпизодическими
в- эндотермическими
в+ экзотермическими
в- эзотерическими
Термодинамическими функциями являются:
в+ H – энтальпия.
в+ S- энтропия.
в+ U – внутренняя энергия.
в- V – объем.
в- p – давление.
1-й закон термодинамики выражается уравнением…
в- DHОБР = -DHРАЗЛ.
в+ Q = DU + АВНЕШ.
в- DG = DH - TDS.
в- H = U – pV.
Самопроизвольное протекание процесса в неизолированной изобарно-изотермической системе сопровождается…
в- возрастанием энтропии.
в- увеличением энергии Гиббса.
в+ уменьшением энергии Гиббса.
в- неизменностью энергии Гиббса.
в- совершением работы против внешних сил.
Экзотермической является реакция…
в- BaCO3(Т) = BaO(Т) + CO2(Г); DH = 258,7 кДж.
в- CaCO3(Т) = CaO(Т) + CO2(Г); DH > 0.
в+ 2Ca(Т) + O2(Г) = 2CaO(Т); DH = -645,6 кДж.
в- MgCO3(Т) = MgO(Т) + CO2(Г); DH = 101,6 кДж.
Тепловой эффект реакции зависит от …
в- конечного и начального состояний системы и зависит от пути процесса.
в+ конечного и начального состояний системы и не зависит от пути проведения процесса.
в- конечного и начального состояний системы и условий проведения процесса.
в- условий проведения процесса и не зависит от начального и конечного состояний системы.
Энтропия при протекании реакции 4NH3(Г) + 3O2(Г) = 2N2(Г) + 6H2O(Г) …
в+ увеличивается.
в- уменьшается.
в- не изменяется.
в- зависит от условий проведения реакции.
Тепловой эффект реакции …. соответствует теплоте образования уксусной кислоты CH3COOH
в- CH4 + CO2 = CH3COOH.
в+ 2C + 2H2 + O2 = CH3COOH.
в- C + O2 + CH4 = CH3COOH.
в- 2CH3COH + O2 = 2CH3COOH.
в- CH3COONa + HCl = CH3COOH + NaCl.
В реакции H2(Г) + Cl2(Г) = 2HCl(Г) выделяется 92,31 кДж.
Энтальпия образования HCl равна …
в- 92,31 кДж/моль.
в- -92,31 кДж/моль.
в- 46,155 кДж/моль.
в+ -46,155 кДж/моль.
Изменение энергии Гиббса при протекании химической реакции вычисляется по уравнению…
| в- | |
| в- | |
| в- | |
| в+ | |
Самопроизвольное протекание процесса в изолированной системе, в соответствии со 2-м законом термодинамики, сопровождается…
в+ возрастанием энтропии
в- уменьшением энтропии
в- увеличением энтальпии
в- неизменностью внутренней энергии
в- неизменностью энергии Гиббса
Реакция, протекающая в прямом направлении с уменьшением энтропии…
в- CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г); DG = 170,63 кДж.
в- Fe2O3(Т) + 3H2(Г) D 2Fe(Т) + 3H2О(Г), DG = 55,28 кДж.
в- 4NH3(Г) + 5O2(Г) D 4NO(Г) + 6H2О(Г), DG = -959,81 кДж.
в+ H2(Г) + CO2(Г) D CO(Г) + H2O(Ж), DG < 0.
Энтропия является функцией состояния и ее изменение равно…
в- сумме энтропий исходных веществ и конечных продуктов.
в- разности между суммой энтропий начальных веществ и суммой энтропий продуктов реакции.
в+ разности между суммой энтропий конечных веществ и суммой энтропий начальных веществ.
в- определяется способом проведения процесса.
При получении 2 моль этанола, согласно термохимическому уравнению C2H4(Г) + H2O (Ж) D C2H5OH(Ж), DH0 = –44 кДж, выделяется … кДж теплоты.
в+ 88
в- 66
в- 44
в- 22
Средняя скорость гомогенной реакции выражается формулой…
в-
в+
в-
в-
Измельчение твердого вещества скорость химической реакции…
в- уменьшает.
в+ увеличивает.
в- не изменяет.
в- замедляет.
Энергия активации обозначена на энергетической диаграмме цифрой …
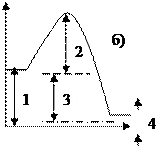
в- 1.
в+ 2.
в-3.
в- 4.
Соответствие между уравнениями реакций и формулами скорости
С1 A + B = D
О1
С2 2A + B = D
О2
С3 2A + 2B = 2D
О3
С4 A2B = 2А + В
О4
О5
Математическая зависимость скорости реакции от температуры описывается уравнением…
в-
в-
в-
в+
Катализатор скорость химической реакции…
в- не изменяет.
в+ увеличивает.
в- уменьшает.
в- замедляет.
в- периодически влияет.
Катализатор изменяет скорость реакции, потому что…
в- удаляет продукты реакции.
в+ взаимодействует с реагирующими веществами, изменяя энергию активации.
в- изменяет температурный коэффициент реакции.
в- смещает положение равновесия в сторону прямой реакции.
Выражение для скорости
в- A + B = C.
в+ 2A + B = C.
в- A + 2B = C.
в- 2A + 2B = 2C.
в- A2B = C + D.
Константа скорости химической реакции равна скорости химической реакции при ...
в- стандартной температуре
в+ стандартных концентрациях реагирующих веществ
в- стандартных давлении и температуре
в- стандартном изменении энергии Гиббса
Температурный коэффициент показывает…
в+ во сколько раз изменяется скорость реакции при повышении температуры на 100.
в- во сколько раз изменяется концентрация при повышении температуры на 100.
в- во сколько раз увеличивается время протекании реакции при повышении температуры на 100.
в- на сколько градусов изменяется температура при протекании реакции.
Соответствие между понятиями и их математическими выражениями
С1 Закон действующих масс
О1
С2 Правило Вант-Гоффа
О2
С3 Уравнение Аррениуса
О3
С4 Скорость химической реакции
О4
О5
Константа скорости реакции
в+ температуры
в- концентрации продуктов реакции
в- давления
в- концентрации исходных веществ
в- присутствия катализаторов
Скорость химической реакции зависит от:
в+ температуры.
в- цвета вещества.
в+ катализатора.
в- формы реактора.
в+ природы вещества.
Скорость обратной химической реакции CaCO3(Т) D CaO(Т) + CO2(Г) описывается уравнением…
в-
в-
в-
в+
в-
Закон действующих масс наиболее строго соблюдается для реакций…
в- гетерогенных
в- последовательных
в- параллельных
в+ гомогенных

