Файл: Контрольная работа по общей и неорганической химии Вариант 57 студент гр. Зукд122 Козлов Е. А. Проверил.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.04.2024
Просмотров: 7
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство науки и высшего образования РФ
Федеральное государственное бюджетное образовательное
учреждение высшего образования
«Владимирский государственный университет им. А.Г. и Н.Г. Столетовых»
Кафедра химии
Контрольная работа по общей и неорганической химии
Вариант № 57
Выполнил:
студент гр. ЗУКд-122
Козлов Е.А.
Проверил:
Красильникова И.А.
Владимир 2023
Задание№1
19. а) Напишите электронную формулу атома кадмия Cd. б) Распределите по квантовым ячейкам электроны двух последних уровней атома кадмия, соблюдая принцип Паули и правило Гунда. в) Зная, что кадмий в соединениях может проявлять высшую валентность, равную II, определите, на каких подуровнях находятся валентные электроны атома кадмия и укажите эти электроны. Напишите значения четырех квантовых чисел для всех валентных электронов атома кадмия.
а)Электронная формула атома: Cd - 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3D^10 4p^6 4d^10 5s^2
б)

в)

Задание№2
48. а) Определите число связей в молекуле NaH2PO4. б) Какая геометрическая конфигурация молекулы SiF4? в) В какой из приведённых молекул SiCl3, AlCl3, CCl4, GeF4 связь элемент - галоген имеет наиболее выраженный полярный характер?
а)
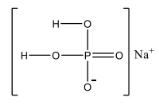
8 связей: 6 одинарных и 1 двойная(фосфор-кислород)
б)
Молекула фторида кремния SiF4 имеет тетраэдрическое строение . Кремний находится в sp3-гибридизованом состоянии, что соответствует тетраэдрической форме.
в)
Самая полярная, значит, наибольшая разница в значениях электроотрицательности элементов.
Ответ : GeF4
Задание№3
72. а) Сколько эквивалентов железа вступит в реакцию с 500 мл 2 м раствора CuSO4? б) В каком количестве KOH содержится столько же эквивалентов, сколько их в 250 г Ca(OH)2? в) Мышьяк образует 2 оксида, из которых один содержит 65,2 % (масс.) As, а другой - 75,7 % (масс.) As. Определите эквивалентные массы мышьяка в обоих случаях
а)
Запишем уравнение химической реакции:
CuSO4 + Fe = FeSO4 + Cu
Определим количество вещества эквивалента для CuSO4:
n(CuSO4) = с(CuSO4) ∙ V(CuSO4)р-ра = 2 ∙ 0,5 = 1 (моль)
так как fэкв(CuSO4) = ½, то
nэкв(CuSO4) = n(CuSO4) ∙ fэкв(CuSO4) = 1 ∙ ½ = 0,5 (моль)
По закону эквивалентов:
nэкв(Fe) = nэкв(CuSO4) = 0,5 моль
Ответ: nэкв(Fe) = 0,5 моль
б)
Определим количество вещества гидроксида кальция.
n(Ca(OH)2) = m(Ca(OH)2)/M(Ca(OH)2) = 250/74 = 3,4 моль
Эквивалентное число гидроксида кальция ½, так как
fэкв(Ca(OH)2) = ½
Количество вещества эквивалента гидроксида кальция равно:
nэкв(Ca(OH)2) = n(Ca(OH)2) ∙ fэкв(Ca(OH)2) = 3,4 ∙ ½ = 1,7 (моль)
По условию количество вещества эквивалента гидроксида калия равно количеству вещества эквивалента гидроксида кальция
nэкв(KOH) = nэкв(Ca(OH)2) = 1,7 (моль)
Рассчитаем массу гидроксида калия
m(KOH) = nэкв(KOH) ∙ M(KOH) = 1,7 ∙ 56 = 95,2 (г)
Ответ: m(KOH) = 95,2 г
в)
Формула оксида As2Ox, учитывая, что кислород в оксидах всегда имеет степень окисления -2
Атомная масса мышьяка 75, значит молярная масса первого оксида
2 ∙ 75/0,652 = 230, то есть кислорода в нем 230 - 150 = 80, что составляет пять атомов и формула оксида As2O5
Эквивалентная масса мышьяка в этом случае 75/5 = 15
Молярная масса второго составляет 2 ∙ 75/0,757 = 198, и на долю кислорода остается 198 - 150 = 48, что составляет три атома, то есть формула оксида As2O3.
Эквивалентная масса мышьяка в этом оксиде 75/3 = 25
Задание№4
Написать уравнение следующих окислительновосстановительных реакций. Определить, какое вещество является окислителем и восстановителем, какое вещество создает среду. Указать степень
окисления элемента окислителя и восстановителя, определить, сколько электронов отдает восстановитель и принимает окислитель. Уравнять коэффициенты в уравнениях реакций.
96. а) Pb + H2SO4 (конц.) = б) (NH4)2S + K2Cr2O7 + H2O = NH3 + в) K2SO3 + KMnO4 + NaOH =
а) Pb + 3 H2SO4 → 2 H2O + SO2 + Pb(HSO4)2
Это окислительно-восстановительная реакция:
Pb0 - 2 e- → PbII (окисление)
SVI + 2 e- → SIV (восстановление)
Pb является восстановителем, H2SO4 является окислителем.
б)
H2O + K2Cr2O7 + 3 (NH4)2S → 3 S + 2 KOH + 6 NH3 + 2 Cr(OH)3
Это окислительно-восстановительная (редокс) реакция:
3 S-II - 6 e- → 3 S0 (окисление)
2 CrVI + 6 e- → 2 CrIII (восстановление)
(NH4)2S является восстановителем, K2Cr2O7 является окислителем.
в)
K2SO3 + 2 KMnO4 + 2 NaOH → H2O + 2 K2MnO4 + Na2SO4
Это окислительно-восстановительная (редокс) реакция:
2 MnVII + 2 e- → 2 MnVI (восстановление)
SIV - 2 e- → SVI (окисление)
KMnO4 является окислителем, K2SO3 является восстановителем.
Задание№5
120. а) Рассчитайте, сколько миллилитров 20%-ного раствора H2SO4 (ρ =1,14 г/см3 ) необходимо взять для приготовления 300 мл 0,5 М раствора. б) В 250 мл воды растворили 5,85 г NaCl. Какова молярность и нормальность полученного раствора? в) Понижение давления пара над раствором бензойной кислоты, содержащим 0,100 моль бензойной кислоты в 760 г сероуглерода, при некоторой температуре равно 7,53 мм рт.ст. Давление пара сероуглерода при той же температуре 760 мм рт.ст. Вычислить молекулярную массу сероуглерода
а)
Сн (H2SO4)=10*w*p/Mэкв (H2SO4)=10*20*1,14 / (98/2)=4,65 моль-экв/л
Сн1*V1=Сн2*V2 V=0,5*300/4,661=32,1 мл
б)
w(NaCl) = m(NaCl)/m(р-ра) = 5,85 г/(250+20) = 0,021,или 2,1% n(NaCl) = m/M = 5,85 г/58,5 г/моль = 0,1 моль Cm(NaCl) = n/V = 0,1 моль/0,25 л = 0,4 моль/л Для хлорида натрия нормальность и молярность - совпадают
Задание№6
144. а) рН раствора азотной кислоты (HNO3) равен 2,8. Сколько граммов этой кислоты содержится в 1л раствора. б) Вычислите рН 0,01 М раствора гидроксида аммония NH4OH, К= 1,8 ·10-5
а)
[H+] = 10^ (-2.8) = 1.58*10^ (-3)
HNO3 - > H (+) + NO3 (-)
H+] = C (HNO3) = 1.58*10^ (-3)
m (HNO3) = C (HNO3) * V (HNO3) * M (HNO3) = 1.58*10^ (-3) * 1 * 63 = 0.0998 г
б)
Kb = 1,8 * 10^-5.
Концентрация гидроксид-анионов в 0,01М растворе составит
корень квадратный(1,8 * 10^-5 * 0,01) = 4,2 * 10^-4.
Определим рН раствора NH4OH:
pOH = -lg[OH^-] = — lg(4,2 * 10^-4) = 3,37; тогда рН = 14 — 3,37 = 10,63.
Ответ: 10,63.
Задание№7
Вычислить H°, G°, S° приведенных ниже реакций. Сделать вывод о возможности протекания приведенных реакций в указанном направлении при 25°С, если реакция при комнатных условиях не идет, выяснить, пойдет ли реакция при других температурах.
162. 4FeSтв + 7O2г = 2Fe2O3тв + 4SO2г
Задание№8
В каждом задании равновесная система относится к пп. «а» и «б». Для п. «а» написать выражение константы равновесия и определить, в какую сторону сместится равновесие при повышении в заданной системе давления, температуры. Ответ обосновать. Какими ещё воздействиями на систему равновесие можно сместить вправо?
199. а) H2 (г) + Br2 (г) ↔2HBr (г). б) Вычислите исходную концентрацию H2, если равновесные концентрации H2, Br2, HBr равны соответственно 0,5 моль/л, 0,1 моль/л, 1,6 моль/л.
а)
ΔНº реакции = ΣΔНºобр. прод. – ΣΔНºобр. исх. в-в
ΔНº реакции = ΔНºобр.2НBr(г) – ΔНºобр.Н2(г)– 3ΔНºобр.Br2(г)
При ст. усл. (Т=298 К, р=1 атм.) ΔНºобр. простых вещ-в (Н2) = 0
ΔНº реакции = 52,3 – 226,75 < 0 - прямая реакция экзотермическая, , поэтому при повышении темп. равновесие сместится в сторону обратной эндотерм. реакции.
Можно сместить равновесие вправо, взяв одно из исх. веществ (Н2 или Br2) в избытке.
Тогда ускорится прямая реакция, в кот. конц-я этого реагента снижается в рез. превращения его в продукт.
б)Соотношение веществ в реакции 1:1:1, т.е. конц-и всех веществ с момента начала реакции до достижения равновесия изменились на одинаковую величину.
Снач. HBr = 1,6моль/л, Сравн. HBr = 1,6 моль/л ΔС HBr = С равн. – С нач.= +1,6 моль/л
т.е. конц-я увеличилась на 1,6 моль/л, значит, до достижения равновесия идет преимущественно прямая реакция.
При этом конц-и Н2 уменьшилась на 1,6 моль/л и стала Br2 0,1 моль/л, значит, нач. конц-я Br2 была 1,6+0,1=1,7 моль/л.
Точно так же конц-и Н2 уменьшилась на 1,6 моль/л и стала 0,5 моль/л, значит, нач. конц-я Н2 была 1,6+0,5=2,1 моль/л.
Задание№9
Напишите в молекулярной и краткой ионной форме уравнения гидролиза солей. Если гидролиз идёт по стадиям. Напишите уравнения гидролиза по стадиям. Укажите условия, при которых происходит данная стадия гидролиза. Укажите, как изменяется pH-среды
209.а) CuCl2 б) Na3PO4 в) Fe(CH3COO)2
а)
Молекулярное уравнение CuCl2 + HOH ⇄ CuOHCl + HCl Полное ионное уравнение Cu2+ + 2Cl- + HOH ⇄ CuOH+ + Cl- + H+ + Cl- Сокращенное ионное уравнение Cu2+ + HOH ⇄ CuOH+ + H+
В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7)
б)
Молекулярное уравнение Na3PO4 + HOH ⇄ Na2HPO4 + NaOH Полное ионное уравнение 3Na+ + PO43- + HOH ⇄ 2Na+ + HPO42- + Na+ + OH- Сокращенное ионное уравнение PO43- + HOH ⇄ HPO42- + OH- В результате гидролиза образовались гидроксид-ионы (OH-), поэтому раствор имеет щелочную среду (pH > 7)
в)
Молекулярное уравнение (CH3COO)2Fe + 2HOH ⇄ 2CH3COOH + Fe(OH)2
В результате гидролиза в растворе в большем количестве присутствуют ионы водорода (H+), потому что Kd. I(основания) = Kd. I(кислоты), следовательно раствор имеет слабо кислую среду (pH < 7)
Задание№10
Рассчитать ЭДС следующих гальванических элементов:
254.Pt, H2 | р-р с рН = 5 | | MnSO4 0,03 н. | Mn
Е° Pt +|Pt =+1,188В
Е° H2+|H = 0 В Электродный потенциал E = E° + (0,059/n)lgC E = 1,188 + (0,059)∙lg0,01 = 1,07 В Вычислим ЭДС гальванического элемента: ЭДС = E0кат — E0ан = E02H+/H2 — E0Pt+/Pt ЭДС = 0 - 1,07 = -1,07 В
Задание№11
264. Латунь, как известно, содержит 60% Cu и 40% Zn. Определите, в каких средах (щелочной, кислой, нейтральной) происходит коррозия латуни. Напишите уравнения реакций, протекающих на анодных и катодных участках при коррозии этой детали в щелочной


