Файл: Отчет по лабораторной работе 3 Вариант 4 по дисциплине.docx
Добавлен: 27.04.2024
Просмотров: 20
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования
ИРКУТСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Институт/Факультет - Вечерне-заочного обучения
Кафедра - Недропользования
Тепловой эффект реакции
Отчет по лабораторной работе № 3
Вариант №4
по дисциплине Химия
| Выполнил Студент, номер группы | ОПз-22-1 (подпись) | М.Е. Баргуев И. О. Фамилия |
| | | |
| Принял Должность | (подпись) | О.В. Кузнецова И. О. Фамилия |
| | | |
| | | |
Иркутск-2023
Лабораторная работа
Определение теплоты реакции нейтрализации
Выполнение работы
Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу Н+ + ОН‾ → Н2О.
Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из двух стаканов – внешнего и внутреннего.
Работу следует выполнять в следующем порядке.
В сухой внутренний стакан калориметра с помощью мерного цилиндра налить 25 мл 1 н. раствора щелочи. В отдельный сухой стакан налить 25 мл 1 н. раствора серной кислоты. Опустить в раствор щелочи термометр. Записать температуру раствора и, не вынимая термометр из калориметра, быстро влить кислоту в щелочь. Осторожно помешивая раствор термометром, отметить и записать максимальную температуру. Эту температуру считать
конечной.
Таблица 1
Данные опыта и результаты расчетов
| Температура Т, К | Изменение энтальпии ∆Н, кДж | ∆Н°нейтр.практ., кДж/моль | ∆Н°нейтр. теор., кДж/моль | Относит. ошибка опыта Е, % | |
| начальная | конечная | ||||
| 299,15 | 304,15 | 1,12 | 44,8 | 285,8 | 84,3% |
1. Вычислить изменение энтальпии реакции ∆Н по формуле:
ΔH = −V ∙ ρ ∙ c ∙ ΔТ,
где V – общий объем раствора, мл; ρ – плотность раствора, г/мл; с – теплоемкость раствора, Дж/(г∙К); ΔТ – разность между конечной и начальной температурами. Принять плотность раствора после нейтрализации равной 1 г/мл, а теплоемкость раствора − равной теплоемкости воды, т.е. 4,18 Дж/(г∙К).
2. Вычислить тепловой эффект реакции нейтрализации ∆Н°нейтр.(практ.) в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л раствора (концентрация равна 1 н.), а для реакции было взято 25 мл, то

3. Используя следствие из закона Гесса, рассчитать теоретическое значение изменения энтальпии реакции нейтрализации ∆Н°нейтр.(теор.) для уравнения реакции:
Н+ + ОН‾ → Н2О.
Значения стандартных термодинамических функций состояния системы приведены в таблице
Таблица 2
Стандартные энтальпии образования ∆Н°298
| Вещество | ∆Н°298, кДж/моль |
| Н+ | - |
| ОН‾ | -230,2 |
| Н2О | -285,8 |
4. Рассчитать относительную ошибку опыта Е (%):
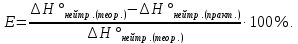
Выполнение работы
-
Вычисляем изменение энтальпии реакции ∆Н по формуле:
ΔH = −V ∙ ρ ∙ c ∙ ΔТ,
где V – общий объем раствора, мл; ρ – плотность раствора, г/мл; с – теплоемкость раствора, Дж/(г∙К); ΔТ – разность между конечной и начальной температурами. Принять плотность раствора после нейтрализации равной 1 г/мл, а теплоемкость раствора − равной теплоемкости воды, т.е. 4,18 Дж/(г∙К).
ΔH =50*1*4,18*5,35=1118,15дж=1,12 кДж
2. Вычисляем тепловой эффект реакции нейтрализации ∆Н°нейтр.(практ.) в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л раствора (концентрация равна 1 н.), а для реакции было взято 25 мл, то

 =44,8 кДж
=44,8 кДж3. Используя следствие из закона Гесса, рассчитаем теоретическое значение изменения энтальпии реакции нейтрализации ∆Н°нейтр.(теор.) для уравнения реакции:
Н+ + ОН‾ → Н2О.
соответственно равны 0; -230,2 и -285,8 кДж/моль.
4. Рассчитаем относительную ошибку опыта Е (%):
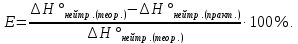
E=285,8-44,8/285,8*100%=84,3%
Вывод: В ходе выполнения лабораторной работы, я освоил методику калориметрических измерений, овладел термохимическими расчетами, определил тепловой эффект реакции нейтрализации серной кислоты щелочью.

