Файл: Отчет по лабораторной работе по физике студент Группа.doc
Добавлен: 28.04.2024
Просмотров: 49
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
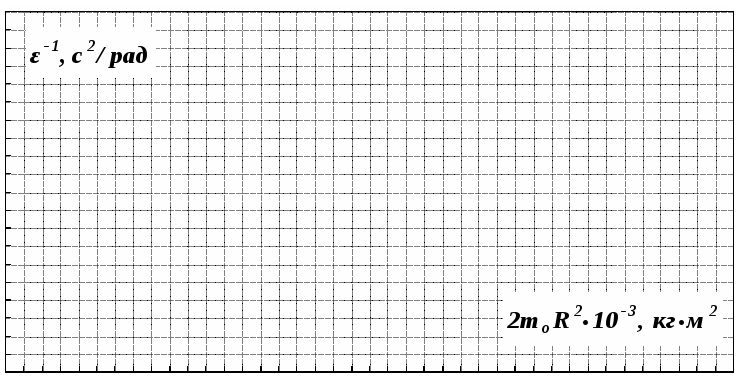
По данным таблицы 2 строится график зависимости 1/ от переменного момента инерции 1/ε=f(2mοR2). Отрезок, отсекаемый графиком на оси моментов инерции, равен моменту инерции маятника без грузов m0 , то есть моменту инерции шкива и спиц.
По данным приборов определяют систематические погрешности tсист и hcист. Поскольку высота, с которой опускается груз каждый раз задается одинаковым образом, то можно считать, что hсл=0. Случайная погрешность в определении времени находится обычным образом по трем измерениям. Полная погрешность находится по формуле t =tcист+tсл. Погрешность r можно положить равной 1 мм. Погрешности в определении углового ускорения рассчитываются по формулам:
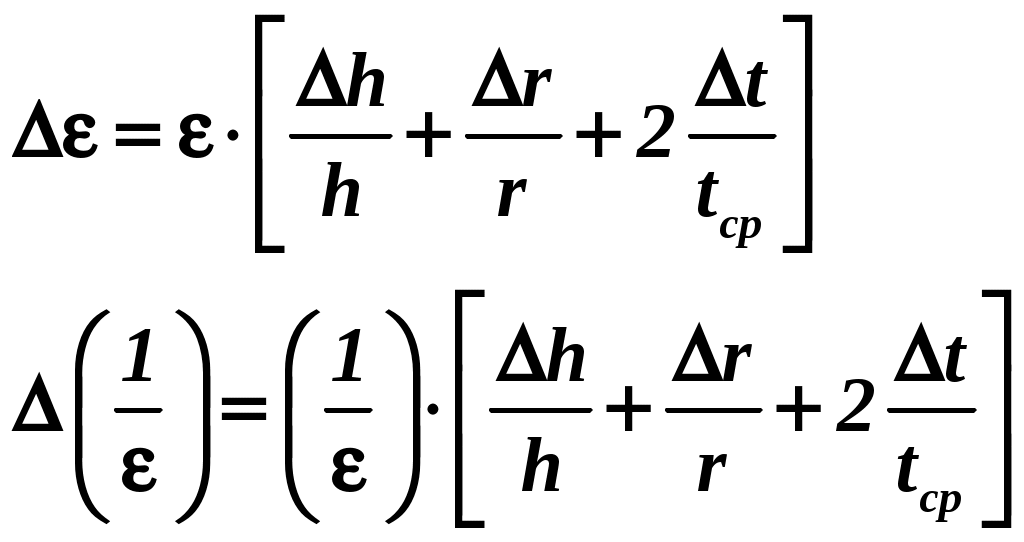 . (16)
. (16)Выражение, стоящее в квадратных скобках, следует рассчитать один раз для средней строки одной из таблиц и использовать это значение для расчета погрешностей и -1 в каждой строке таблиц 1 и 2. По результатам работы сделать соответствующие выводы.
КОНТРОЛЬНЫЕ ВОПРОСЫ
-
Записать и объяснить основной закон динамики вращательного движения. Дать определения величин, входящих в это уравнение. -
Как определяется направление углового ускорения и момента сил? -
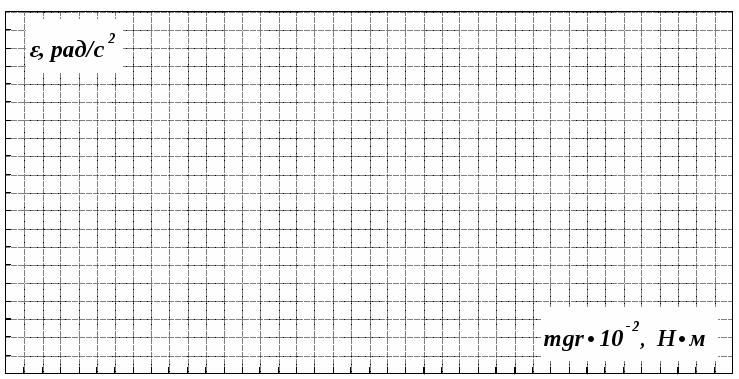
Какой физический смысл имеет отрезок, отсекаемый прямой на оси абсцисс на графике ε=f(mgr)? -
Какой физический смысл имеет отрезок, отсекаемый прямой на оси абсцисс на графике 1/ε=f(2mοR2)?
ОТЧЕТ
| ТЕОРЕТИЧЕСКИЙ КОНСПЕКТ (ответы на контрольные вопросы): |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| ВЫЧИСЛЕНИЯ: |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| ВЫВОДЫ: |
| |
| |
| |
| |
| |
Номер варианта и данные к расчету
Лабораторная работа №7
Таблица 1.
-
№
варианта
№
Р1,
мм. рт. ст.
Р3,
мм. рт. ст.
1
6
11
16
21
26
1
120
22
2
118
21
3
122
22
4
119
19
5
116
18
2
7
12
17
22
27
1
130
27
2
126
25
3
122
22
4
125
27
5
124
22
3
8
13
18
23
28
1
128
26
2
126
24
3
123
22
4
127
27
124
23
4
9
14
19
24
29
1
120
23
2
119
21
3
122
25
4
119
20
5
117
19
5
10
15
20
25
30
1
122
25
2
125
28
3
122
25
4
119
23
5
1128
30
ЛАБОРАТОРНАЯ РАБОТА №7.
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ ТЕПЛОЕМКОСТЕЙ ГАЗА МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Цель работы. Ознакомиться с методом адиабатического расширения, определить коэффициент Пуассона для воздуха.
Теоретическое введение. Удельной теплоемкостью вещества называется величина, численно равная количеству теплоты, которое необходимо сообщить веществу единичной массы, чтобы увеличить его температуру на один Кельвин:
Единица удельной теплоемкости в системе СИ – джоуль на килограмм-кельвин: [с] = Дж / (кгК).
Молярной теплоемкостью вещества называется величина, численно равная количеству теплоты, которое необходимо сообщить молю вещества, чтобы увеличить его температуру на один Кельвин:
Единица молярной теплоемкости в системе СИ – джоуль на моль-кельвин: [С] = Дж / (мольК).
Для газов удельная и молярная теплоемкости зависят от условий, при которых проводится нагревание. Между собой теплоемкости связаны соотношением:
где М – молярная масса вещества.
Согласно первому началу термодинамикиколичество теплоты
Изменение внутренней энергии идеального газа определяется формулой:
где – количество вещества, dT– изменение температуры, R – универсальная газовая постоянная,i – число степеней свободы газа. Для одноатомных молекул (инертные газы) i=3, для двухатомных (простые газы, кроме инертных) –
i=5, для многоатомных (сложные газовые соединения) – i=6.
Нагреем один моль газа на dT градусов. Если объем газа не изменяется, т.е. V=const, то газ работы не совершает, т.е.
Если при нагревании моля газа остается постоянным давление, т.е. P=const, то газ расширяется и совершает работу (рис. 1). Молярная теплоемкость газа, измеренная при постоянном давлении, определяется формулой:
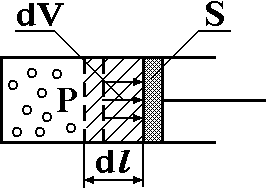
Рис. 1. Расширение газа при нагревании.
Расширившись, газ отодвинет легкий поршень площадью S на расстояние dl(рис. 1). Работа газа
Подставив выражения (8) и (6) в (7) получим:
Таким образом, чтобы нагреть газ при постоянном давлении, необходимо больше тепла, чем для нагревания такого же количества газа до той же температуры при постоянном объеме, так как в первом случае тепло расходуется не только на повышение внутренней энергии газа, но и на работу газа против внешних сил.
Запишем уравнение Клапейрона – Менделеева для моля газа
Продифференцируем его, считая давление постоянным:
отсюда
Тогда уравнение (9) можно переписать в виде:
. (13)
Это уравнение называется уравнением Майера.
Из соотношения (12) следует физический смысл универсальной газовой постоянной: R числена равна работе изобарного расширения одного моля идеального газа при его нагревании на один Кельвин.
Непосредственное определение теплоемкостей довольно затруднительно, особенно CV. При рассмотрении многих задач в расчетные уравнения входит коэффициент Пуассона, который равен отношению теплоемкостей
Адиабатическим процессом называется такой процесс, при котором не происходит теплообмена между исследуемой системой и внешней средой (
ОПИСАНИЕ УСТАНОВКИ
Схема установки представлена на рисунке 2. В сосуд насосом накачивают воздух, создавая давление выше атмосферного. Это состояние газа соответствует началу эксперимента, на графике (рис.3) это точка 1. При этом газ имеет параметры Р1,V1,T1.

Рис. 2. Схема эксперимен-тальной установки.
Быстрое расширение воздуха можно рассматривать как адиабатическое. Поэтому, открывая клапан сосуда на мгновение, в течение которого давление внутри сосуда достигает атмосферного, мы можем считать, что газ перейдет в новое состояние, характеризуемое величинами Р2,V2,T2 по адиабате (точка 2 на рисунке 3). Температура воздуха в сосуде после адиабатического расширения будет ниже начальной. Параметры начального и конечного состояний воздуха в сосуде при адиабатическом процессе связаны уравнением Пуассона (уравнением адиабаты):


