Файл: Лекции Первое начало термодинамики Удельная и молярная теплоёмкости.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 21
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Тема 5. Основы термодинамики
План лекции
1. Первое начало термодинамики
2. Удельная и молярная теплоёмкости
3. Работа идеального газа. Круговые циклы
4. Тепловые машины. Второе начало термодинамики
5. Энтропия
6. Цикл Карно и его КПД для идеального газа
7. Явления переноса
Термодинамика возникла как эмпирическая наука об основных способах преобразования внутренней энергии тел для совершения механической работы. Первые паровые машины появились во второй половине 18 века и ознаменовали наступление промышленной революции. Учёные и инженеры стали искать способы увеличить их эффективность, и в 1824 году Сади Карно в сочинении «О движущей силе огня и о машинах, способных развивать эту силу» установил максимальный коэффициент полезного действия тепловых машин. Термодинамика как наука ведёт своё начало с этой работы, которая долгое время оставалась неизвестной современникам.
В 40-х годах 19 века Майер и Джоуль количественно определили связь между механической работой и теплотой и сформулировали универсальный закон сохранения и превращения энергии. В 50-е годы Клаузиус и Кельвин систематизировали накопленные к тому времени знания и ввели понятия энтропии и абсолютной температуры.
В конце 19 века феноменологическая термодинамика была развита в работах Гиббса, который создал метод термодинамических потенциалов, исследовал общие условия термодинамического равновесия, установил законы равновесия фаз и капиллярных явлений.
В 1906 году Нернст опубликовал работу, в которой была сформулирована теорема, впоследствии получившая его имя и известная как третье начало термодинамики.
Аксиоматические основы термодинамики были в строгой форме впервые сформулированы в трудах Каратеодори в 1909 году.
1. Первое начало термодинамики.
Термодинамика – раздел физики, изучающий общие свойства макроскопических систем, не касаясь микропроцессов.
Основу термодинамики образует 2 её начала:
1-ое начало термодинамики : Количество теплоты, переданное системе, идет на изменение внутренней энергии и совершение работы против внешних сил.
dQ=dU+dA
Первый закон термодинамики применителен к изопроцессам.
1. Изотермический T=const, то dU=0; dQ=dA
2. Изохорный V=const, то dA=0; dQ=dU
3. Изобарный P=const, то dQ=dU+dA
4. Адиабатный ΔQ=0;
A=- ΔU-адиабатное расширение
ΔU= -A-адиабатное сжатие.
2. Удельная и молярная теплоёмкости.
Теплоёмкость - физическая величина, численно равная отношению количества теплоты, которое необходимо затратить, чтобы нагреть систему на 1 К.
Теплоёмкость бывает:
-
удельной -
молярной
Удельная теплоёмкость вещества- это количество теплоты, которое необходимо для нагревания 1 кг вещества на 1 К.
dQ=c ∙m ∙dT
Молярная теплоёмкость- это количество теплоты, которое необходимо для нагревания 1 моля вещества на 1 К.
dQ=CυdT
υ-количество вещества.
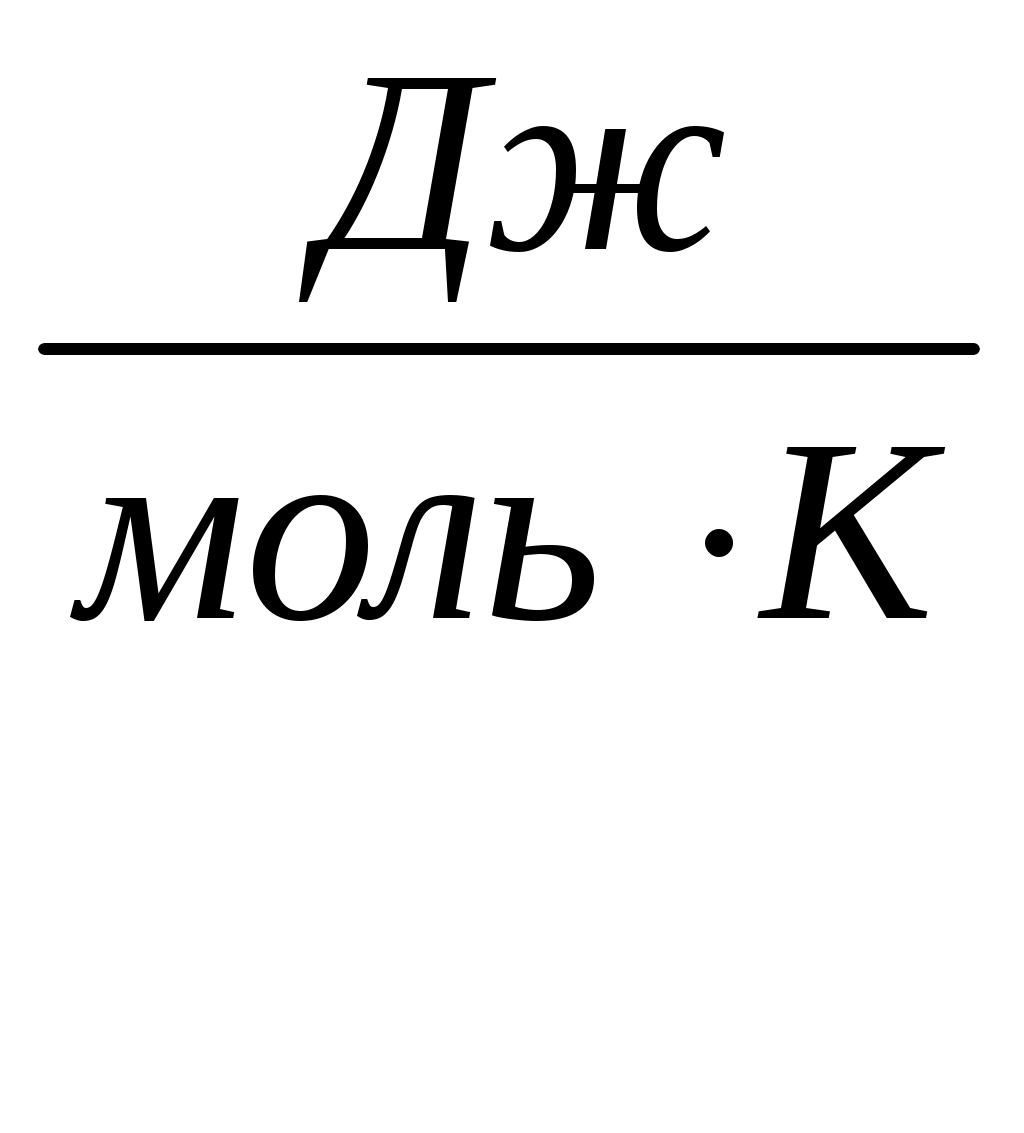
Удельная и молярная теплоёмкости связаны между собой формулой:
Теплоёмкость тела зависит: от его массы, химического состава, термодинамического состояния и вида того процесса о котором телу передается энергия.
В адиабатном процессе
В изотермическом процессе
Теплоёмкости при постоянном давлении называется Ср, при постоянном объёме - Сv
Ср = Сv + R ,-уравнение Майера
где R-универсальная газовая постоянная
В термодинамике важное значение имеет величина
3. Работа идеального газа. Круговые циклы.
Пусть газ находится в сосуде, который закрыт поршнем.










 F
F




 газ
газ
Δ l
 S-площадь поршня. Переместим поршень на расстояние
S-площадь поршня. Переместим поршень на расстояние силы F. При этом совершится работа:
А= F·
Известно, что
Т.о.
а) A=
б) при изохорном процессе А=0 , т.к. V=const
в) при изотермическом процессе Т= const
обозначим
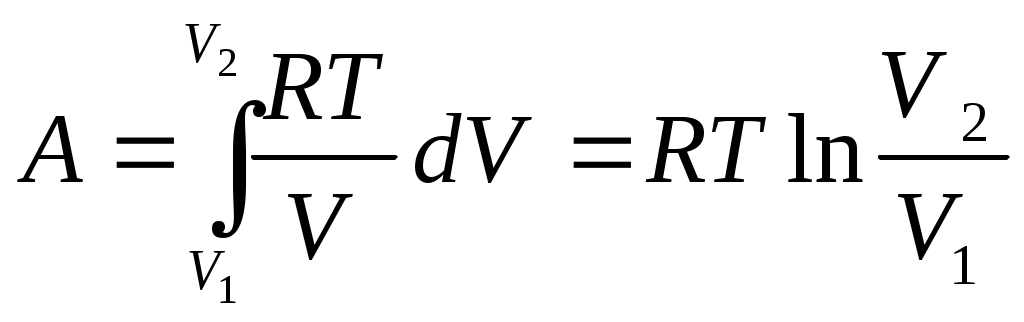
т.к.
г) dA=-dU, обозначим dU=CVdT
dA=- CVdT
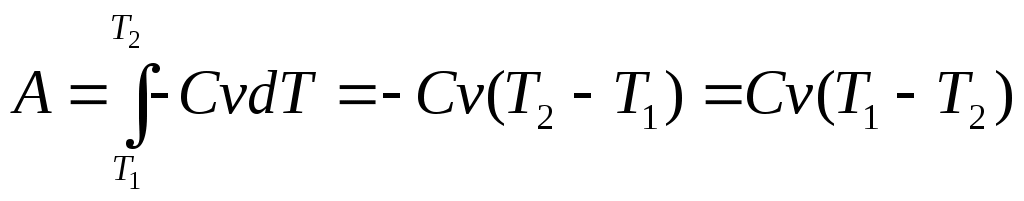
A=Cv(T1-T2)
Циклические (круговые) процессы. Работа цикла
Круговым процессом или циклом называется процесс, при котором система, пройдя ряд состояний, возвращается в исходное состояние. На pV- диаграмме цикл изображается замкнутой кривой. Если цикл осуществляется по часовой стрелке (I), то он называется прямым, если в обратном направлении (II)- обратным.
Совершив цикл, система возвращается в исходное состояние. Поэтому изменение внутренней энергии за цикл равно нулю, т.е. dU=0. Следовательно, работа, совершенная системой, будет равна количеству теплоты полученному системой. Работа, совершенная системой равна площади цикла на pV- диаграмме. Однако нужно иметь в виду, что в процессе осуществления цикла, система не только получает , но и отдает некоторое количество теплоты и, следовательно
Q=Q1– Q2 , где Q1– количество теплоты,
полученное системой, Q2 – отданное системой количество теплоты (Q2 <0).


 р
р
 I
I



II

 V
VПоэтому термический коэффициент полезного действия цикла можно найти по формуле:
Цикл называется обратным, если он может осуществляться как в прямом, так и в обратном направлении и при этом в окружающей среде и в самой системе не происходит никаких изменений. Всякий другой процесс, не удовлетворяющий этим условиям будет необратим.
Работа цикла определяется по формуле:
Ац=Арасшир.-Асжат.
Процесс будет обратимым, если он является равновесным. Обратимость равновесного процесса следует из того, что его любое промежуточное состояние также является состоянием термодинамического равновесия.
4.Тепловые машины. Второе начало термодинамики.
Второе начало термодинамики устанавливает необратимость макроскопических процессов. Первая формулировка этого начала была дана в 1850 году Клаузиусом: невозможен процесс, при котором теплота самопроизвольно переходила бы от менее нагретого к более нагретому.
Исторически второе начало термодинамики возникло из анализа работы теплового двигателя.
Тепловой двигатель представляет собой систему, работающую за счет внешних источников тепла, которая периодически повторяет тот или иной термодинамический цикл и преобразует теплоту в механическую работу.
