Файл: Решение. G 2GСО) (GСН4 GСО2) 2 137, 14 ( 50, 82 394, 38) 617, 46 кДж т.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 8
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Задача 116.
Прямая или обратная реакция будет протекать в системе
Ответ мотивируйте, вычислив
Решение.
ΔG°₂₉₈ = 2ΔG°₂₉₈СО) - (ΔG°₂₉₈СН4 + ΔG°₂₉₈СО2) = - 2 * 137, 14 - ( - 50, 82 + 394, 38) = - 617, 46 кДж
т.
К. ΔG°₂₉₈ меньше нуля, возможно протекание прямой реакции.
Задача 142.
Константа равновесия реакции
равна единице. Сколько процентов вещества A подвергается превращению, если смещать 3 моль вещества A и 5 моль вещества B?
Решение.
Пусть превращению подверглось х молей вещества А, тогда, согласно уравнению реакции, израсходуется столько же молей вещества В, и образуется столько же молей веществ С и D. [A][В] /[C][D] = 1 [A][В] = [C][D] (3 – x)(5 – x) = x² 15 – 8x + x² = x² 15 – 8x = 0 x = 15/8 = 1.875 моль
Еще одно решение
Уравнение реакции имеет вид:
Н2(г) + Br2(г) = 2HBr(г)
Согласно уравнению реакции из 1 моля Н2 и 1 Br2 образуется 2 моль HBr. Обозначим количество израсходованных исходных веществ через x. Тогда равновесные концентрации реагирующих веществ будут раны:
[Н2] = (3 – х) моль/л, [Br2] = (2 – х) моль/л, [HBr] = (2х) моль/л. Подставив эти значения концентраций в выражение константы равновесия реакции, рассчитаем значение x:
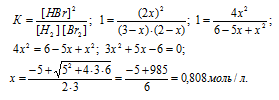
Тогда равновесные концентрации веществ будут равны:
[Н2] = 3 - 0,808 = 2,192 моль/л;
[Br2] = 2 – 0,808 = 1,192 моль/л;
[HBr] = 2. 0,808 = 1,616 моль/л.
Находим объёмы газов в равновесной системе, учитывая, что 1 моль любого газа при нормальных условиях занимает 22,4л, получим:
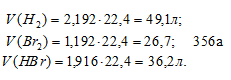
Тогда общий объём газовой равновесной системы будет равен 112 л (49,1 + 26,7 + 36,2 = 112).
Теперь определим состав газов (в процентах по объему) равновесной реакционной смеси по формуле:
w% - объёмная доля вещества, выраженная в процентах, V(в-ва) - объём вещества, V(смеси) - общий объём газовой смеси.
Тогда

Ответ: 43,84% Н2; 23,84% Br2; 32,32%HBr.
Задача 246.
Напишите в молекулярной и ионно-молекулярной форме уравнения реакций нейтрализации и укажите, какая из них протекает обратимо, а какая – необратимо. Укажите также реакцию среды (нейтральная, кислая, щелочная) при условии, если основание и кислота взяты в строго эквивалентных количествах.
Решение.
-
2HCl + Ba(OH)2 → BaCl2 + 2H2O 2H(+) + 2Cl(-) + Ba(2+) + 2OH(-) → Ba(2+) + 2Cl(-) + 2H2O H(+) + OH(-) → H2O (двойки сократить надо) 2) Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O Fe(OH)2 + 2H(+) + 2NO3(-) → Fe(2+) + 2NO3(-) + 2H2O H(+) + OH(-) → H2O (двойки сократить надо) 3) При нагревании обратима H2S + 2NaOH ⇄ Na2S + 2H2O H2S + 2Na(+) + 2OH(-) ⇄ 2Na(+) + S(2-) + 2H2O H(+) + OH(-) ⇄ H2O (двойки сократить надо) Молекулярное уравнение: Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Задача 272.
Реакции протекают по схемам:
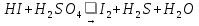
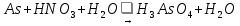
Используя электронно-ионный метод, уравняйте эти реакции. Для каждой реакции определите эквивалент окислителя и восстановителя.
Решение.
Общий принцип: 1) находим окислитель (степень окисления понижается в результате приёма электронов) и восстановитель (степень окисления повышается в результате отдачи электронов) 2) Составляем электронно-ионные уравнения, записывая только реально существующие в растворе частицы; в кислой среде лишний кислород убирается протонами, в щелочной среде кислород берется из гидроксид-анионов; в левой и правой частях уравнения не могут одновременно находиться протоны и гидроксид-анионы, т. е. если в левой части будет один из ионов, то в правой - вода. 3) Уравниваем число отданных и принятых электронов с помощью коэффициентов для уравнений полуреакций, суммируем полуреакции. 4) В обе части уравнения добавляем необходимое число противоионов (например, для Cr3+ добавляем 3Cl- и т. п.) 5) Записываем уравнение в молекулярном виде.
As-5e=As+5 N+5 +3e=N+2 3As+5HNO3+2H2O=3H3AsO4+5NO
В результате взаимодействия иодоводорода с серной кислотой (HI + H2SO4 = ?) происходит образование свободного йода, воды и выделение газа – сероводорода. Молекулярное уравнение реакции имеет вид:

Запишем ионные уравнения, учитывая, что простые вещества, газы и вода на ионы не распадаются, т.е. не диссоциируют.

Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Сероводород в обычных условиях представляет собой бесцветный газ с характерным запахом гниющего белка. Он немного тяжелее воздуха и горит голубоватым пламенем, образуя диоксид серы и воду:
Сероводород легко воспламеняется; смесь его с воздухом взрывает. Очень ядовит. При
 один объем воды растворяет 2,5 объема сероводорода. Раствор сероводорода в воде называется сероводородной водой.
один объем воды растворяет 2,5 объема сероводорода. Раствор сероводорода в воде называется сероводородной водой.Сероводород – сильный восстановитель. При действии сильных окислителей он окисляется до диоксида серы или до серной кислоты; глубина окисления зависит от условий: температуры, рН раствора, концентрации окислителя. Например, реакция с хлором обычно протекает до образования серной кислоты:
Средние соли сероводорода называют сульфидами.
При высокой температуре сера взаимодействует с водородом, образуя газ сероводород.
Практически сероводород обычно получают действием разбавленных кислот на сернистые металлы, например на сульфид железа:
Задача 324.
Вычислите молярную массу эквивалентов железа, если при прохождении через раствор соли железа тока силой 5 А в течение 5,36 часа выделилось 27,9 г Fe.
Для определения молярной массы эквивалента воспользуемся формулой m = m(э) * (I*t/F)
где m(э) — молярная эквивалентная масса металла, элемента
I — сила пропускаемого тока
t — время процесса электролиза в секундах
F — постоянная Фарадея равная 96500.
Отсюда эквивалентная масса m(э) = m*F/(I*t) = 2,96 * 96500/ (5*30*60) = 31,74 г/моль (32 г/моль)
Для определения элемента помножим валентность на найденную величину
2 * 32 = 64 — элемент медь
Поэтому можно сделать вывод, что вещество, подвергшееся электролизу это сульфат меди (II).
Схема электролиза раствора сульфата меди на инертных электродах будет выглядеть так:
CuSO4=Cu (2+) +SO4(2-)
K: Cu (2+) +2e=Cu (0)
A: 2H2O-4e=O2(0) +4H (+)
Суммарная реакция: 2CuSO4 + 2H2O = 2Cu (0) + O2(0) + 2H2SO4
