ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.05.2024
Просмотров: 14
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Автономная некоммерческая организация профессионального образования «Открытый социально-экономический колледж»
Экономика и бухгалтерский учет по отраслям СОО 38.02.01
Дисциплина: Естествознание
Практическое задание №3
Выполнил:
Слушатель Вишнякова А.Н.
Преподаватель : Васильцова А.С.
Тула - 2023
Задание 1. Численной характеристикой способности атомов данного элемента соединяться с другими атомами называется валентностью. Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум. Валентность углерода в органических веществах равна IV, а азота III.
Составьте структурные формулы молекул С3Н8
C3H8, СН2О, СН5, С2Н5Сl
C3H8 –
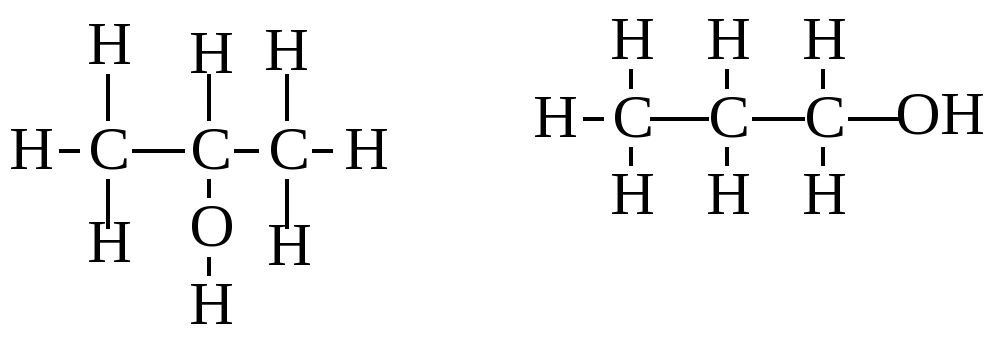
СН2О –
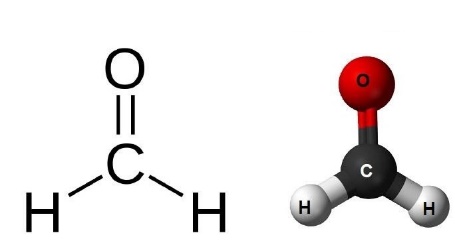
СН5N –
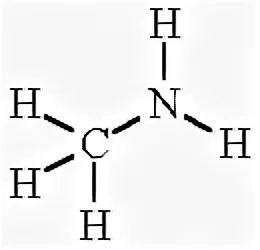
С2Н5Сl –
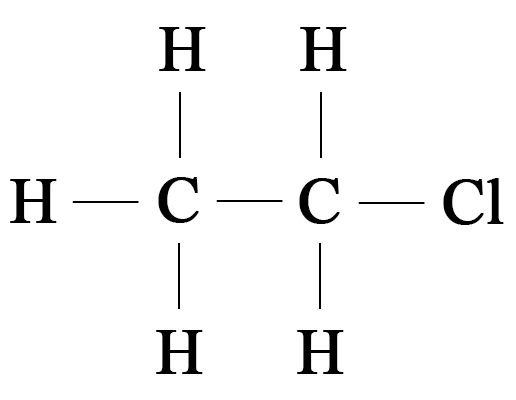
Задание 2. Составьте все изомеры для С6Н14 и С3Н6О2
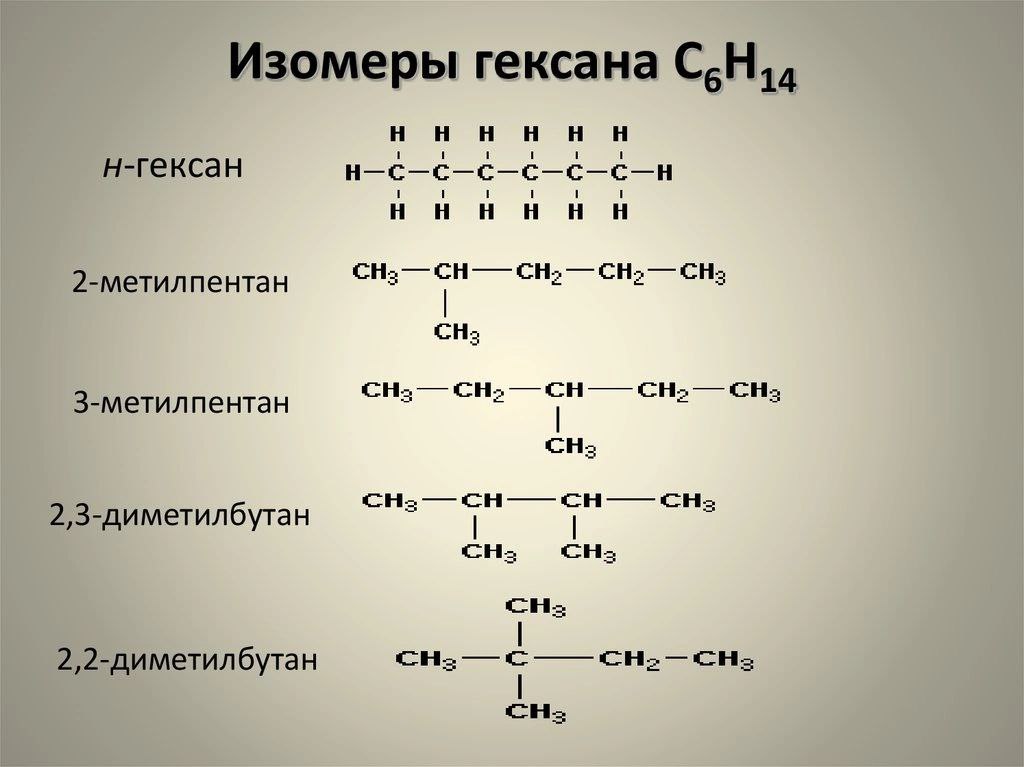
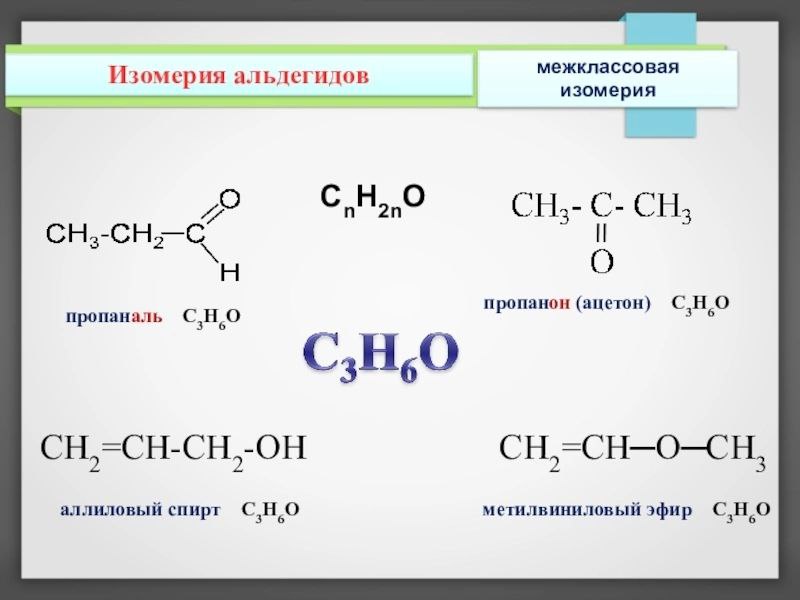
Задание 3. Установите соответствие между уравнением реакции и типом химической реакции
уравнение реакции
1) СаСОз + СО2 + Н2О = Са(НСО3)2 - Б
2) 4NH3 + 3O2 =2N2 + 6H2O + Q - В
3) NaOH+HCI = NaCI+H2O - Г
4) 2NO = N2 +O2 - А
тип химической реакции
а) разложения
б) соединения
в) замещения
г) обмена
Задание 4. Рассмотрите таблицу «Смещение химического равновесия» и выполните задания:
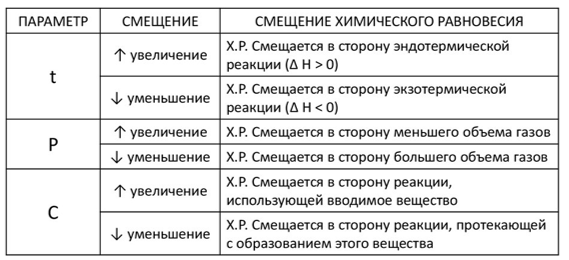
а) Куда сместится равновесие: С(т)+ О2(г)↔️СО2(г) при увеличении давления?
1) влево 2) вправо 3) не сместится
б) Куда сместится равновесие: PCl5(г)↔️PCl3(г)+Cl2(г) при уменьшении температуры, если прямая реакция является эндотермической?
1) влево 2) вправо 3) не сместится
в) Установите соответствие между фактором, действующим на равновесную
систему N2(г) + 3H2(г) ↔️ 2NH3(г) + 45,9 кДж и направлением смещения химического равновесия в этой системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФАКТОР НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
А) добавление катализатора 1) смещается в сторону продуктов реакции
Б) повышение концентрации 2) смещается в сторону исходных
аммиака веществ
В) понижение температуры 3) не происходит смещения равновесия
Г) повышение давления
Задание 4.
Ответ:
а) - 3)
б) - 1)
в) А-3; Б-2; Г - 1.
Объяснение:
а) Куда сместится равновесие: С(т)+ О₂(г) ⇄ СО₂(г) при увеличении давления?
Ответ 3) не сместится.
Увеличение давления смещает равновесие в сторону меньших объемов газообразных веществ.
По реакции объемы газов в исходных веществах и продуктах реакции равны (по коэффициентам 1 объем O₂ в исходных веществах, 1 объем CO₂ в продуктах реакции). Равновесие не сместится при изменении давления.
б) Куда сместится равновесие: PCl₅(г) ⇄ PCl₃(г)+Cl₂(г) - Q при уменьшении температуры, если прямая реакция является эндотермической?
Ответ 1) влево, в сторону исходных веществ.
Уменьшение температуры смещает равновесие в сторону экзотермической реакции, а у нас прямая реакция является эндотермической, следовательно равновесие сместится в сторону обратной реакции, т.е. в сторону исходных веществ.
в) N₂(г) + 3H₂(г) ⇄ 2NH₃(г) + 45,9 кДж
А) - 3) не происходит смещения равновесия
Катализатор не смещает равновесия, он ускоряет и прямую и обратную реакции
Б) - 2) смещается в сторону исходных веществ
Повышение концентрации аммиака сместит равновесие в сторону его разложения, т.е. влево, в сторону исходных веществ.
Г) - 1) смещается в сторону продуктов реакции
Повышение давления смещает равновесие в сторону меньших объемов.
Исходные вещества: 1 объем N₂(г) + 3 объема H₂(г) = 4 объема
Продукты реакции: 2 объема NH₃(г).
Объем продуктов реакции меньше.
