Файл: Взаимодействие ароматических карбонильных соединений с nнуклеофилами Строение аминов.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.05.2024
Просмотров: 20
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Были осуществлены разнообразные эпидемиологические исследования среди парикмахеров и косметологов. Незначительное, но непрерывное повышение риска рака мочевого пузыря имеет место у мужчин-парикмахеров. Эксперты МАИР оценили подобные данные как ограниченное доказательство канцерогенности данной экспозиции для человека и отнесли ее к вероятно канцерогенной (группа 2А).
Анализ эпидемиологических данных по персональному использованию красок для волос не привел к однозначной оценке в отношении канцерогенной опасности для пользователей. Подобная экспозиция определена как неклассифицированная в отношении канцерогенной опасности для человека (группа 3).
1.3 Реакции нуклеофильного присоединения по карбонильной группе
Стехиометрия реакций нуклеофильного присоединения реагента:NuH к карбонильному соединению представляется следующим уравнением
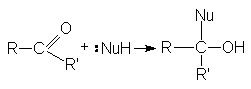
Рисунок 1.5 – Стехиометрия нуклеофильного присоединения реагента
Атака нуклеофильного реагента на карбонильный атом углерода ведет к разрыву p -связи карбонильной группы. Возникающий в данном случае интермедиат претерпевает последующие превращения, приводящие к появлению продуктов нуклеофильного присоединения.
Реакции нуклеофильного присоединения по карбонильной группе могут быть реализованы при кислотном, основном катализе или некаталитически.
В некаталитической реакции реализуется механизм:

Рисунок 1.6 – Некаталитическая реакция
При кислотном катализе собственно нуклеофильной атаке предшествует протонирование субстрата.

Рисунок 1.7 – Кислотный катализ
При основном катализе функция катализатора состоит в образовании ввиду кислотно-основного взаимодействия с реагентом более сильного нуклеофила, успешно атакующего карбонильный углерод.
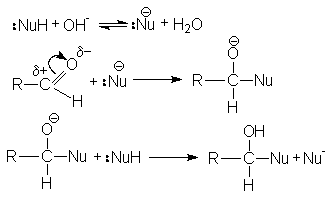
Рисунок 1.8 – Основной катализ
1.3.1 Кислотно-каталитическая реакция образования ацеталей и полуацеталей

Рисунок 1.9 – Кислотно-каталитическая реакция образования ацеталей и полуацеталей
Механизм образования полуацеталей согласуется с общим механизмом кислотно-каталитического нуклеофильного присоединения по карбонильной группе

Рисунок 1.10 – Общий механизм кислотно-каталитического нуклеофильного присоединения
Чем больше частичный положительный заряд на карбонильном атоме углерода, тем легче он атакуется нуклеофильной частицей, поэтому электроноакцепторные заместители повышают реакционную способность альдегидов и кетонов, а электронодонорные снижают.
Вторичная реакция образования ацеталей является типичной кислотно-каталитической реакцией образования простого эфира
1.3.2 Образование гидратов альдегидов
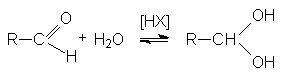
Рисунок 1.11 – Реакция образования гидрата альдегида
Механизм этой реакции подобен механизму образования полуацеталей. Положение равновесия зависит от структуры альдегидов и условий реакции.
1.3.3 Взаимодействие с гидросульфитом (бисульфитом) натрия
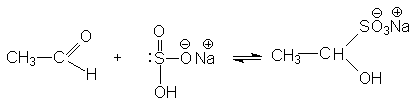
Рисунок 1.12 – Взаимодействие с гидросульфитом натрия
Катализатор в этой реакции не требуется, поскольку гидросульфит – анион в ионной паре соли является довольно эффективным нуклеофильным агентом.
Продукты присоединения гидросульфита с карбонильным соединением – хорошо кристаллизующиеся вещества, нерастворимые в водном растворе гидросульфита натрия. Ввиду этого их применяют для отделения карбонильных соединений от веществ, с которыми гидросульфит натрия не вступает в реакции. При нагревании с раствором соды или щелочей полученные аддукты разлагаются с образованием сульфита натрия и регенерацией карбонильного соединения.
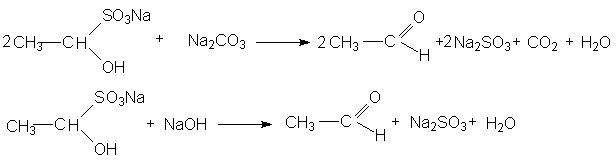
Рисунок 1.13 – Реакция образования сульфита натрия и регенерации карбонильного соединения
Необходимо также сказать о том, что в реакцию с гидросульфитом натрия вступают лишь альдегиды и метилкетоны.
1.3.4 Замещение кислорода карбонильной группы на галогены
Галогенирующими агентами по отношению к альдегидам и кетонам выступают галогениды фосфора, серы и т.д.
При взаимодействии с этими реагентами, которые являются сильными электрофилами, происходит активация карбонильного соединения, сопровождающаяся нуклеофильной атакой галогенид–аниона на карбонильный углерод.
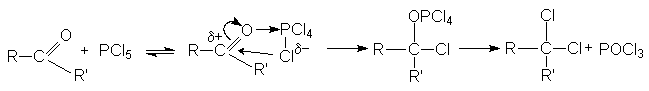
Рисунок 1.14 – Реакция замещения кислорода карбонильной группы на галогены
1.3.5 Взаимодействие с реактивами Гриньяра
В результате взаимодействия с углеродсодержащими нуклеофилами наращивается углеродный скелет карбонильного соединения, благодаря чему эти реакции имеют широкое применение в синтетической органической химии. Такими нуклеофилами служат: реактивы Гриньяра, циановодородная кислота, различные соединения с выраженными CH-кислотными свойствами.
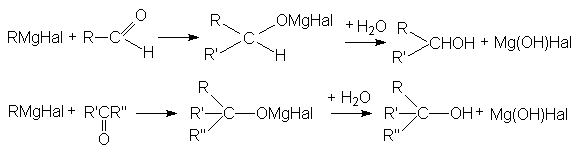
Рисунок 1.15 – Реакции взаимодействия с реактивами Гриньяра
Поскольку в молекуле реактива Гриньяра углеводородный радикал имеет карбанионный характер, то он выступает в роли нуклеофильного агента по отношению к карбонильному углероду субстрата.
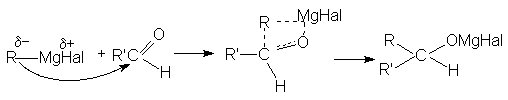
Рисунок 1.16 – Образование углеводородного радикала
1.3.6 Образование циангидринов
Реакция катализируется основаниями, потому что в слабой циановодородной кислоте концентрация активных нуклеофильных частиц — цианид-ионов — очень низка. Медленной стадией является присоединение цианид-иона.
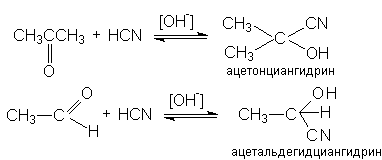
Рисунок 1.17 – Реакции образования ацетонциангидрина и ацетальдегидциангидрина
В этих реакциях значение основного катализа состоит в галогенировании эффективного нуклеофила.

Рисунок 1.18 – Реакции галогенирования эффективного нуклеофила
Продукты реакции, циангидрины, имеют практическое значение, связанное с получением мономеров для производства синтетических волокон и пластмасс – метакрилонитрила, метакриламида, метилметакрилата, акрилонитрила, акриламида, метилакрилата
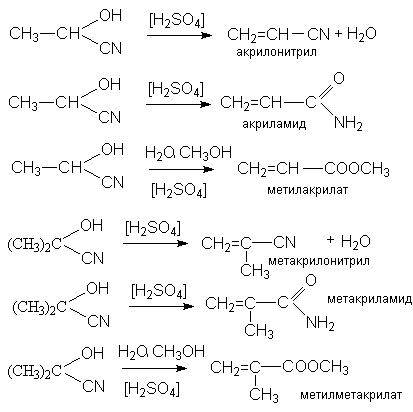
Рисунок 1.19 – Реакции образования циангидринов
1.3.7 Реакции нуклеофильного присоединения азотистых оснований
К данным реакциям целесообразно отнести следующие:
а) образование иминов (азометинов) – оснований Шиффа

Рисунок 1.20 – Образование иминов
б) образование оксимов
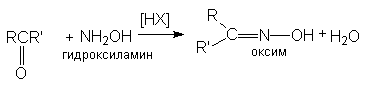
Рисунок 1.21 – Образование оксимов
в) образование гидразонов
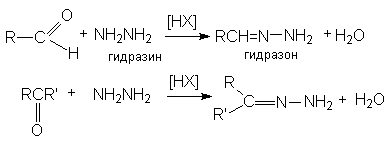
Рисунок 1.22 – Образование гидразонов
г) синтез семикарбазонов
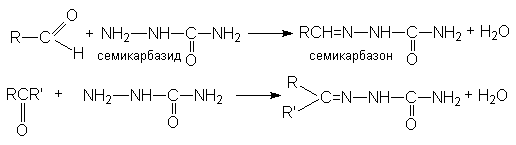
Рисунок 1.23 – Синтез семикарбазонов
Все эти реакции протекают по единому механизму, причем кислотный катализ не только ускоряет первичный акт нуклеофильного присоединения, но и способствует эффективному отщеплению воды на дальнейших этапах. Обозначив азотистое основание NH2X, можно представить общий механизм их взаимодействия с карбонильными соединениями при катализе кислотой HY.
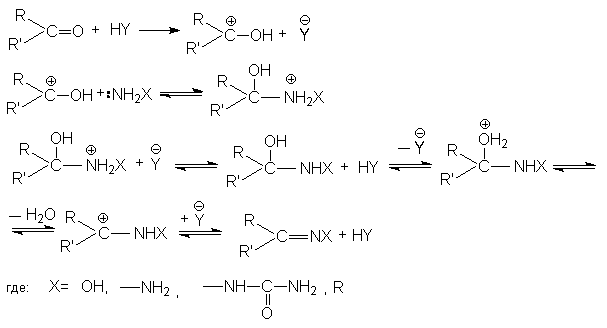
Рисунок 1.24 – Взаимодействие нуклеофильных соединений с карбонильными
Присоединение нуклеофила к карбонильному соединению протекает через биполярный ион и ведет к появлению неустойчивого гем-аминоспирта, подвергающемуся далее дегидратации в конечный продукт. Подобное протекание реакции альдегидов и кетонов с соединениями, включающими аминогруппу, аргументирует их общее название как реакций присоединения — отщепления.
Скорость данных реакций присоединения-отщепления находится в зависимости от pH среды. При достаточно существенных показателях pH медленной (скорость-определяющей) стадией является отщепление воды от протонированной формы гем-аминоспирта. В процессе роста кислотности среды концентрация катиона увеличивается, и протекание реакции замедляется. При небольших показателях pH скорость-определяющей стадией является взаимодействие карбонильного соединения с нуклеофилом, что связано с тем, что в сильнокислой среде нуклеофил XHN2 существует в виде неактивного аммониевого иона XNH
3+.
Соответственно, оптимум процесса в такой ситуации приходится на pH приблизительно равное 4.
1.4 Опасное действие и влияние на организм
Производство и промышленное использование определенных ароматических аминов способны оказывать крайне существенные и порой необратимые опасности. Но сейчас подобные опасности (риски) почти в полном объеме исследованы ввиду научно-технического прогресса, ввиду чего очевидно имеет место закономерность к замене определенных веществ и создания специальных мер защиты. Помимо всего прочего, актуальна дискуссия о вероятности воздействия ароматических аминов на здоровье человека, являясь элементами конечного продукта или выделениями в ходе химических реакций, идущих при применении их производных, или – специфичная ситуация - как итог метаболического разложения в организме сложных производных.
Ключевой риск абсорбции заключается в соприкосновении с кожей: практически все ароматические амины растворимы в липидах. Данный факт крайн важен, поскольку в ходе производства на предприятии его зачастую не принимают во внимание. Помимо абсорбции через кожу есть риск проникновения подобных веществ в организм через дыхательные пути. Это способно иметь место при вдыхании паров - несмотря на то, что немало ароматических аминов обладает низкой летучестью при комнатной температуре. Крайне опасны в подобном плане соли аминов, например сульфаты и хлоргидрат, имеющие крайне невысокую летучесть и растворимость в липидах. С практической точки зрения при соприкосновении с ними риск профессиональных заболеваний ниже, но их общая токсичность такая же, как в соответствующих аминов, ввиду чего вдыхание пыли данных солей и соприкосновение с кожей обязаны считаться опасными.
Потенциальную опасность таит попадание через пищеварительный тракт, при нереализации установленных санитарных норм, или несоблюдении персоналом правил личной гигиены (например, курение). Многие из ароматических аминов являются горючими, ввиду чего они представляют пожарную опасность. Продукты их горения способны обладать высокой степенью токсичности.
1.7 Применение ароматических аминов
Ароматические амины являются обширным классом химических веществ, являющихся ценными как с технической, так и с промышленной точки зрения.

