Файл: Федеральное государственное автономное образовательное учреждение высшего образования СанктПетербургский политехнический университет Петра Великого.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 8
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Федеральное государственное автономное образовательное учреждение высшего образования
«Санкт-Петербургский политехнический университет Петра Великого»

ОТЧЁТ
По лабораторной работе №5
“Ионные реакции в растворах электролитов”
Дата первой сдачи отчёта: __________
Дата принятия отчёта: __________
Выполнил(а): ____________ Мамиева Виктория Андреевна (№ 3332201/20002)
Принял: ____________Марков Виктор Андреевич
Цель работы:
-
исследовать образование слабых электролитов в гомогенной системе:
а) образование слабого основания
б) образование устойчивой слабой кислоты
в) образование неустойчивой слабой кислоты
-
исследовать образование малорастворимых соединений:
а) переосаждение малорастворимых веществ
б) растворение (нерастворение) осадка под действием сильной кислоты
Теоретическое обоснование:
Ионными реакциями (реакциями обмена) называют реакции в растворах электролитов, не сопровождающиеся изменением степеней окисления атомов элементов, входящих в состав реагирующих веществ.
Электролиты - вещества, растворы или расплавы которых проводят электрический ток.
Сильными называются электролиты, степень диссоциации которых больше 0,3 (α>30%). К сильным электролитам относятся:
-
Почти все соли -
Сильные кислоты: НCl, HBr , HI, HNO3, HClO3, HBrO3, HIO3, H2SO4 и др. -
Сильные основания: МОН, где M–щелочной элемент (Li ÷ Fr); M(OH)2, где М – щелочноземельный элемент (Са ÷ Rа)
Слабыми называются электролиты, степень диссоциации которых меньше 0,03 (α<3%). К слабым электролитам относятся все остальные кислоты и основания, а также немногочисленные средние соли, продукты первичной диссоциации кислых солей, основных солей и комплексных солей, вода.
Константа равновесия — величина, которая показывает соотношение между концентрациями продуктов реакции и исходными веществами, которая устанавливается при равновесии.
Для гомогенной реакции aA+bB ⇋cC+dD, константа равновесия равна:
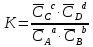
Константа диссоциации (KD) - это отношение произведения концентрации диссоциированных ионов к концентрации недиссоциированных молекул электролита.
Для одноосновных кислот оно описывается общим уравнением
HA ⇋ H+ + A- ,
Где А—кислотный остаток.
Константу этого равновесия называют константой диссоциации кислоты:
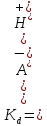
Рассмотрим конкретный пример:
Молекулярное уравнение:
Al(OH)3+NaOH(конц.)⇋Na[Al(OH)4]
Полное ионное уравнение:
Al(OH)3+Na++OH-⇋Na++[Al(OH)4-]
Краткое ионное уравнение:
Al(OH)3 + OH-⇋[Al(OH)4]- (1)
Малорастворимое вещество Al(OH)3 и слабый электролит [Al(OH)4]- находятся в равновесии с продуктами той незначительной диссоциации, которой они подвергаются:
Al(OH)3↓ ⇋ Al3++3OH-
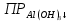 =[Al3+]·[OH-]3 (2)
=[Al3+]·[OH-]3 (2)[Al(OH)4]- ⇋ Al3++4OH-
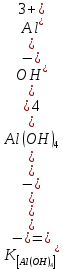 (3)
(3)При вычитании (3) из (2) получаем (1), константа равновесия которого равна:
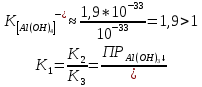
Значит, процесс(1) протекает преимущественно в прямом направлении.
Константа в общем виде для ионного равновесия в краткой форме:
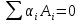
где Ai – слабые электролиты, осадки или недиссоциирующие ионы, возникающие при диссоциации сильных электролитов, αi – стехиометрические коэффициенты (αi < 0 для исходных реагентов, αi > 0 для продуктов реакции).
Правило Бертолле формулируется так: реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода).
Таким же образом можно получить константу равновесия:
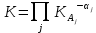
где
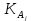
− константа полной диссоциации слабого электролита Aj.
Для ионной реакции α1PQ ↓+α2ST ⇋α3PT+α4SQ ↓
Где PQ, SQ - осадки, ST, PT- слабые электролиты
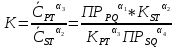
Где
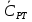 и
и 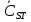 – равновесные молярные концентрации.
– равновесные молярные концентрации.Отсюда можно сделать вывод, что чем слабее электролит PT и
чем менее растворим осадок SQ, тем больше значение константы равновесия K. Таким образом, чем более слабые электролиты и чем менее растворимые осадки образуются в результате ионной реакции, тем полнее идет процесс в прямом направлении.
Индикаторы - вещества, которые изменяют свою окраску в зависимости от характера среды раствора. В зависимости от оцениваемых параметров индикаторы бывают таких видов:
-
Кислотно-основные. Позволяют определить уровень pH, что дает представления о принадлежности раствора к кислотам либо щелочам. -
Металлоиндикаторы. Определяют, присутствуют ли в соединении вещества, относящиеся к металлам. -
Окислительно-восстановительные. Определяют наличие в смеси окисляющих компонентов. -
Термические. Меняют цвет при нагреве. -
Адсорбционные. Меняют оттенок, впитываясь в выпавший на дно осадок в силу электростатики.
В данной работе использовались кислотно-основные индикаторы: фенолфталеин и лакмус.
Малиновый цвет фенолфталеина появляется лишь при достижении определённых показателей pH среды. И чтобы результаты анализа были достоверными, нужно знать рабочие значения. Рассмотрим интервалы в единицах измерения водородного показателя:
-
От 0 до 3 – сильнокислые среды. Оттенок становится оранжевым. -
От 4 до 8 – слабокислые растворы и нейтральные. В них вещество остаётся прозрачным. -
От 8,2 до 10 единиц – слабощелочные и щелочные растворы. В них возникает малиновая окраска – от сиреневого и светло-розового до фуксинового, пурпурного, ярко-фиолетового оттенка. Интенсивность зависит от pH. -
Более 11-12 единиц – сильнощелочные среды. В них индикатор сохраняет прозрачность.
Рассмотрим интервалы в единицах измерения водородного показателя для лакмуса:
-
От 1 до 3 показывает высокий уровень кислотности; -
От 4 до 6 показывает кислую среду; -
7 — нейтральный результат, именно он в большинстве случаев считается оптимальным в том случае, когда анализы проводятся в домашних условиях; -
От 8 до 11 показывает щелочную среду; -
От 12 до 14 показывает высокий уровень щелочи.
Опыт 1. Образование слабого основания.
Последовательность действий.
-
Внести в пробирку немного разбавленного раствора гидроксида натрия. -
Добавить каплю фенолфталеина, затем добавить несколько капель раствора хлорида аммония. -
Нагреть пробирку. -
По запаху определить образование аммиака. -
Написать уравнение процесса разложения гидроксида аммония и объяснить изменение цвета индикатора.
Экспериментальные результаты.
Реакция взаимодействия гидроксида натрия и хлорида аммония:
NaOH+NH4Cl ⇋ NaCl+NH4OH
Na++OH-+NH4++Cl- ⇋Na++Cl-+NH4OH
NH4++OH- ⇋ NH3 + H2O
Составим выражение константы равновесия:
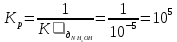
После добавления фенолфталеина к раствору гидроксида натрия индикатор изменяет цвет с бесцветного на малиновый. Изменение окраски фенолфталеина вызывают гидроксид-ионы (OH-). После добавления раствора хлорида аммония раствор обесцветился, т.к. NH4OH разлагается на NH3 и H2O, где NH3 улетучивается, а H2O имеет нейтральную среду, из-за чего равновесие реакции смещается в сторону прямой реакции.
Опыт 2. Образование устойчивой слабой кислоты.
Последовательность действий.
-
Внести в пробирку несколько капель разбавленной серной кислоты. -
Добавить каплю лакмуса. Затем добавить несколько капель раствора ацетата натрия.
3. Нагреть пробирку.
4. По запаху определить образование уксусной кислоты.
5. Запишите молекулярное и ионное уравнение реакции серной кислоты и ацетата натрия, объяснить изменение цвета индикатора.
Экспериментальные результаты.
Молекулярное и ионное уравнение реакции серной кислоты и ацетата натрия:
H2SO4 + 2CH3COONa = 2CH3COOH + Na2SO4
2H+ + SO42- + 2CH3COO- + 2Na+ = 2CH3COOH + 2Na+ + SO42-
H+ + CH3COO- = CH3COOH
Составим выражение константы равновесия:
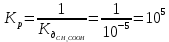
После добавления лакмуса к раствору разбавленной серной кислоты индикатор изменяет цвет с бесцветного на красный. Изменение окраски лакмуса вызывают ионы водорода (H+). После добавления раствора ацетата натрия цвет раствора приобрел фиолетовый оттенок, т.к. в ходе реакции серная кислота превращается в соль, и образуется уксусная кислота, которая является более слабой по сравнению с серной. Константа диссоциации
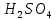 больше, чем у
больше, чем у  , соответственно, концентрация ионов водорода уменьшится. Константа равновесия >1, равновесие смещается в сторону прямой реакции.
, соответственно, концентрация ионов водорода уменьшится. Константа равновесия >1, равновесие смещается в сторону прямой реакции.Опыт 3. Образование неустойчивой слабой кислоты.
Последовательность действий.
-
Налить в пробирку несколько капель раствора карбоната натрия. -
Добавить в эту же пробирку немного разбавленной серной кислоты. -
Наблюдать за выделением газа. -
Составить уравнения происходящего превращения, рассчитать константу равновесия.
Экспериментальные результаты.
Молекулярное и ионное уравнение реакции карбоната натрия и разбавленной серной кислоты:
Na2CO3 + H2SO4 = Na2SO4 +H2CO3
2Na+ + CO32- + 2H+ + SO42- = 2Na+ + SO42- + H2CO3
2H+ + CO32- = H2CO3
Составим выражение константы равновесия:
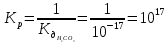
Реакция протекает полностью и необратимо, т.к. в результате реакции выделяется углекислый газ, который покидает систему и образуется вода. Равновесие смещено в сторону прямой реакции.
Опыт 4. Переосаждение малорастворимых веществ.
Последовательность действий.
-
Внести в пробирку несколько капель раствора нитрата свинца(II) и сульфата натрия. -
Добавить в ту же пробирку несколько капель раствора хромата калия. -
Перемешать содержимое пробирки стеклянной палочкой. -
Составить уравнения происходящего превращения, рассчитать константу равновесия.


