Файл: Федеральное государственное автономное образовательное учреждение высшего образования СанктПетербургский политехнический университет Петра Великого.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 9
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Экспериментальные результаты.
Молекулярное и ионное уравнение реакции нитрата свинца(II) и сульфата натрия:
Pb(NO3)2 + Na2SO4 = PbSO4↓+ 2NaNO3
Pb2+ + 2NO3- + 2Na+ + SO42- = PbSO4↓+ 2Na+ + 2NO3-
Pb2+ + SO42- = PbSO4↓
При взаимодействии нитрата свинца(II) и сульфата натрия выделяется сульфат свинца(II), который выпадает в осадок белого цвета.
Составим выражение константы равновесия:
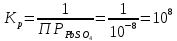
Молекулярное и ионное уравнение реакции сульфата свинца(II) и хромата калия :
PbSO4 ↓+ K2CrO4 = PbCrO4 ↓+ K2SO4
PbSO4 + 2K+ + CrO42- = PbCrO4 ↓+ 2K + SO42-
PbSO4 + CrO42- = PbCrO4 ↓+ SO42-
Составим выражение константы равновесия:
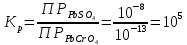
При взаимодействии сульфата свинца(II) и хромата калия выделяется хромат свинца желтого цвета.
Сульфат свинца и хромат свинца плохо растворимы в воде, однако некоторое количество ионов все-таки образуется. В результате хромат будет осаждаться, а сульфат – вступать в реакцию и истрачиваться, т.к. произведение растворимости PbSO4 много больше, чем произведение растворимости PbCrO4.
Опыт 5. Растворение (нерастворение) осадка под действием сильной кислоты.
Последовательность действий.
-
Насыпать в одну пробирку микрошпателем немного сульфата железа(II) и растворить его в нескольких каплях воды. -
В другую пробирку добавить небольшое количество раствора сульфата меди(II). -
В каждую из пробирок внести немного раствора сульфида натрия. -
Затем в каждую из пробирок добавить несколько капель разбавленной соляной кислоты. -
Наблюдать за растворением осадка в одной из пробирок. -
Описать происходящие химические процессы с помощью молекулярных и ионных уравнений. -
Рассчитайте константы равновесия.
Экспериментальные результаты.
Молекулярное и ионное уравнение реакции сульфата железа(II) и сульфида натрия:
FeSO4 + Na2S = FeS ↓ + Na2SO4
Fe2+ + SO42- + 2Na+ + S2- = FeS ↓+ 2Na+ + SO42-
Fe2+ + S2- = FeS ↓
Составим выражение константы равновесия:
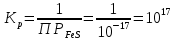
При взаимодействии сульфата железа(II) и сульфида натрия выделяется сульфид железа(II), который выпадает в осадок черного цвета. Константа равновесия >1, равновесие смещено в сторону прямой реакции.
Молекулярное и ионное уравнение реакции сульфата меди(II) и сульфида натрия:
CuSO4 + Na2S = CuS ↓ + Na2SO4
Cu2+ + SO42- + 2Na+ + S- = CuS ↓+ 2Na+ + SO42-
Cu2+ + S2- = CuS ↓
Составим выражение константы равновесия:
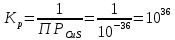
При взаимодействии сульфата меди(II) и сульфида натрия выделяется сульфид меди(II), который выпадает в осадок черного цвета. Константа равновесия >1, равновесие смещено в сторону прямой реакции.
Молекулярное и ионное уравнение реакции сульфида железа(II) и разбавленной соляной кислоты:
FeS ↓+ 2HCl = FeCl2 + H2S ↑
FeS↓+2H++2Cl-=Fe2++2Cl-+ H2S ↑
FeS+2H+= Fe2++ H2S ↑
Составим выражение константы равновесия:
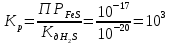
Константа равновесия >1, равновесие смещено в сторону прямой реакции.
Молекулярное и ионное уравнение реакции сульфида меди и разбавленной соляной кислоты:
CuS↓ + 2HCl = CuCl2 + H2S ↑
CuS↓+2H++2Cl-=Cu2++2Cl-+ H2S ↑
CuS+2H+= Cu2++ H2S ↑
Составим выражение константы равновесия:

Константа равновесия <1, равновесие смещено в сторону обратной реакции, реакция не будет протекать.
Вывод.
Было исследовано образование слабых электролитов в гомогенной системе:
а) образование слабого основания – в первом опыте был получен гидроксид аммония при взаимодействии гидроксида натрия и хлорида аммония.
б) образование устойчивой слабой кислоты – во втором опыте была получена уксусная кислота при взаимодействии серной кислоты и ацетата натрия.
в) образование неустойчивой слабой кислоты – в третьем опыте была получена угольная кислота, распадающаяся на CO2 и H2O, при взаимодействии карбоната натрия и разбавленной серной кислоты.
Также исследовано образование малорастворимых соединений:
а) в четвертом опыте - переосаждение малорастворимых веществ, хромата свинца и сульфата свинца.
б) в пятом опыте - растворение (нерастворение)
осадка под действием сильной кислоты, сульфата меди сульфата железа(Ⅱ).
Санкт-Петербург
20__


