ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 35
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
"Классы соединений"
-
Неорганические вещества являются электролитами различной силы. Укажите количество ионов, образующихся при диссоциации соли KHSO4: Два -
Укажите эмпирическую формулу ортофосфорной (ортофосфатной) кислоты: H3PO4 -
Для лечения некоторых заболеваний кожи, например, бородавок, папилломы, применяют жидкий азот. Укажите класс данного соединения: Простое -
Проанализируйте изменение кислотно-основных свойств в ряду соединений: HCl – HBr – HI. Укажите характер данных изменений: Кислотные свойства уменьшаются -
Укажите продукты реакции: MgOHCl + HCl MgCl2 + H2O; -
Укажите эмпирическую формулу оксида азота (IV): NO2; -
Укажите эмпирическую формулу сульфата гидроксокальция: CaOHSO4. -
Укажите реагент, с которым может взаимодействовать CuO: HCl; -
Укажите соль, которая образуется при взаимодействии 1 моль гидроксида кальция и 2 молей H2SO4: СaSO4; -
Среди перечисленных веществ, укажите реагент, способный вступать во взаимодействие с хлоридом натрия: AgNO3;
"Биогенные s- и р-элементы"
-
При сбоях в работе калий-натриевого насоса возникает заболевание – маниакальная депрессия. Укажите элемент, ионы которого входят в состав препарата, применяемого для лечения данного заболевания. Li+; -
Цинк оказывает влияние на физиологические процессы. Укажите, в чем заключается биологическая роль данного элемента. Влияет на процессы размножения; -
Натрий - незаменимый макроэлемент третьего периода периодической системы. Укажите, в чем это проявляется биологическая роль данного элемента. Принимает участие в обеспечении осмотического давления в клетках -
0,9% раствор некоторого соединения натрия применяется в виде изотонического раствора и назначается внутривенно. Укажите название данного соединения. Хлорид натрия ; -
Один из биогенных элементов является самым распространенным на земле. Укажите данный элемент. Кислород; -
Кальций находится в каждой клетке организма, общее его содержание составляет 1,4%. Укажите место максимальной концентрации ионов данного элемента в организме. Костный скелет; -
Хлор – биогенный р-элемент, способный образовывать анионы различной степени устойчивости. Укажите анион, обладающий наименьшей окислительной активностью. ClO4- -
Ионы Са2+ с некоторым аналитическим реагентом образуют белый кристаллический осадок. Укажите данный аналитический реагент. (NH4)C2O4; -
Некоторое соединение применяется для гипсовых повязок при переломах и в зубоврачебной практике при изготовлении слепков ротовой полости. Укажите данное соединение. CaSO4•2H2O; -
Фосфор – незаменимый элемент, входящий в состав гидрофосфат- и дигидрофосфат-ионов фосфатной буферной системы организма. Определите электронную конфигурацию, которая соответствует атому фосфора в составе этих ионов. 1s22s22p6;
"Биогенные d-элементы"
-
Никель входит в состав некоторых лекарственных препаратов. Укажите физиологический процесс, на который влияют данные препаратыНа морфологический состав крови -
Один из d-элементов принимает участие в биохимических процессах в качестве переносчика электронов в дыхательной цепи. Укажите такой элемент. Zn -
При проведении аналитической реакции на ионы Fe2+ образовался темно-синий осадок Fe3[Fe(CN)6]. Определите аналитический реагент, который использовался в данной реакции. К3[Fe(CN)6]; -
Один из d-элементов с выраженными металлическими свойствами растворяется только в «царской водке». Укажите данный элемент. Платина; -
Хром, являясь элементом VI B группы, в соединениях способен проявлять различные степени окисления. Укажите свойства, характерные для гидроксида хрома (ІІІ). Амфотерные; -
Недостаточное содержание в организме одного из d-элементов приводит к нарушению костеобразования в детском возрасте. Определите данный d-элемент. Cu; -
При действии едкой щелочи на растворы солей меди (ІІ) образуется нерастворимый в воде осадок. Укажите цвет данного осадка. Голубой -
Одно из соединений меди используется в медицинской практике как антисептическое и прижигающее средство. Укажите такое соединение. CuSO4; -
Кобальт входит в состав жизненно важного витамина. Укажите название данного витамина и функцию кобальта в нём. В12 – в качестве комплексообразователя -
Радиоактивное золото используется в медицинской практике для лечения некоторых заболеваний. Укажите название заболеваний, для лечения которых применяется данный препарат. Злокачественные опухоли;
Основы химической термодинамики
-
Любая биологическая системы обменивается с окружающей средой энергией и массой. Укажите, к каким термодинамическим системам ее можно отнести: Открытая, гетерогенная -
Cтуденты изучали влияние различных параметров на течение самопроизвольно протекающих процессов. Укажите выражение, которое соответствует таким процессам: 0, ∆Н<0; ∆U<0, 0; ∆U<0 -
Энтальпия - это сумма внутренней энергии и работы расширения системы. Укажите уравнение, которое используется для расчета данной величины:
-
В реальных системах термодинамический процесс может сопровождаться как увеличением, так и уменьшением энтропии. Укажите процесс, в котором данная величина уменьшается: Полимеризация -
На лабораторной-практической части занятия студенты изучали параметры системы, в которой происходил обмен с окружающей средой только энергией. Укажите тип данной системы Закрытая -
Значения энтальпии образования известны приблизительно для 8000 соединений, что позволяет определить расчетным путем тепловые эффекты разнообразных реакций. Укажите вещество, для которого эта термодинамическая функция равна нулю: Cl2 -
Энтальпия - это сумма внутренней энергии и работы расширения системы. Укажите уравнение, которое используется для расчета данной величины: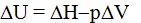
-
Изменение состояния любой системы характеризуется рядом термодинамических функций. Укажите одну из них: Энтальпия -
При окислении глюкозы в организме свободная энергия Гиббса (ΔG) имеет большое отрицательное значение. Укажите вывод, какой возможно сделать на основании этого: Процесс идет самопроизвольно -
В ходе проведения реакции окисления азота кислородом поглотилось значительное количество теплоты. Укажите, с точки зрения термодинамики, название данного процесса: Эндотермический -
Первый закон термодинамики является отображением всеобщего принципа сохранения энергии. Укажите математическое выражение этого закона: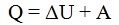
-
В термодинамике различают несколько видов термодинамических процессов. Один из них проходит без обмена тепла с окружающей средой, т.е. система не получает тепло извне и не отдает его окружающей среде. Укажите название такого процесса: Адиабатный -
Cтуденты изучали влияние различных параметров на течение самопроизвольно протекающих процессов. Укажите выражение, которое соответствует таким процессам: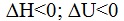
-
Для моделирования самопроизвольно протекающих биохимических процессов в организме необходимо знать их направление. Укажите критерий принципиальной возможности такого процесса: ΔG<0 -
Изменение свободной энергии Гиббса (ИG) ) это максимальная работа, которую организм выполняет за определенное время. Укажите уравнение, при помощи которого можно рассчитать данную термодинамическую функцию: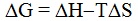
-
Многие биохимические процессы происходят при постоянном давлении и температуре. Укажите функцию состояния, которая является критерием протекания самопроизвольного процесса при этих условиях: Энергия Гиббса -
Термодинамика изучает свойства различных термодинамических систем и происходящие в них процессы. Укажите систему, которая не обменивается с окружающей средой ни массой, ни энергией: Изолированная -
Необратимые процессы старения организма связаны с изменением функции состояния – энтропией. Укажите, мерой какой энергии является данная термодинамическая функция: Рассеянная энергия -
Организм человека О это термодинамическая система. В каждый момент времени состояние системы характеризуется рядом термодинамических параметров. Укажите один из них: Температура -
Для различных преобразований важно знать не абсолютное значение энтропии, а ее изменение ((S). Укажите уравнение, которое возможно применить для таких расчетов :S. = Sпрод - Sисх.
Растворы. Способы выражения состава растворов.
-
В хирургии применяют гипертонические повязки (марля, смоченная в 10% гипертоническом растворе NaCl ), которые вводять в гнойные раны. Укажите количество граммов соли и воды необходимое для приготовления 500 г данного раствора: 50 г соли и 450 г воды -
Процентная концентрация раствора Н2С2О4 (ρ=1,075 г/мл) составляет 12,3%. Определите величину молярной концентрации (моль/л) данного раствора. 1,47 -
В фармацевтической практике применяются растворы различных веществ с заданной концентрацией. Укажите формулу для расчета молярной концентрации: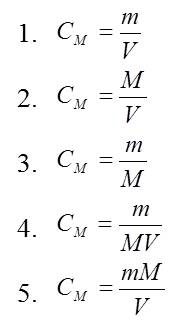
-
Хлорид ртути (II) (сулема) HgCl2 в концентрации 1:1000 применяется для дезинфекции и как антисептик.Определите тип данного раствора: Ненасыщенный -
Растворимость веществ зависит от различных факторов.Укажите характеристику, описывающую меру растворимости вещества при данных условиях: Концентрация его насыщенного раствора -
Самым распространенным растворителем является вода. Укажите, какой объем воды необходимо использовать для приготовления 2%-ного раствора из 10г соли: 490мл -
Количественной характеристикой раствора является его молярная концентрация, которая показывает число молей растворенного вещества в определенном объеме растворителя. Укажите этот объем в литрах. 1,0 -
Студент получил задание рассчитать массу вещества в растворе, исходя из значений молярной концентрации раствора и объема вещества. Укажите формулу, которую он должен применить для расчета.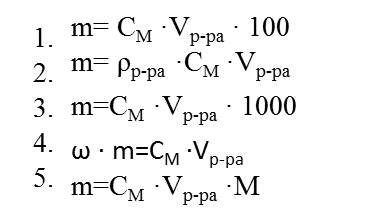
-
Растворимость твердых веществ зависит от условий растворения. Укажите, что происходит с растворимостью данных веществ, при повышении температуры: Возрастает -
Студент получил задание расчитать массу вещества в растворе исходя из значений массовой доли вещества и плотности раствора. Укажите формулу, которую он должен применить для расчета:
-
3 % раствор NaCl назначают внутрь для промывания желудка при отравлении AgNO3, который при этом превращается в малорастворимый и нетоксичный серебра хлорид. Укажите, сколько граммов соли и воды необходимо взять для приготовления 200г раствора NaCl с заданной концентрацией: 6,0г соли и 194г воды -
5% раствор лактозы применяется как питательное средство при искусственном кормлении грудных детей. Определите массу лактозы и воды, содержащихся в 250 г такого раствора: 12,5г и 237,5г -
Некоторые методы клинических анализов предусматривают применение растворов с точной молярной концентрацией. Укажите, какую посуду необходимо использовать для приготовления данных растворовМерные колбы -
Молярная концентрация является количественной характеристикой раствора. Укажите формулу для ее расчета: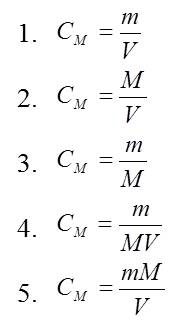
-
Изменение температуры влияет на растворимость большинства твердых веществ. Укажите, что происходит с растворимостью данных веществ, при понижении температуры: Уменьшается -
В клинической практике применяются растворы различных веществ с заданной концентрацией. Укажите формулу для расчета моляльной концентрации:
-
Укажите процесс, какой будет происходить при охлаждении насыщенного раствора хлорида магнияКристаллизация -
Молярная концентрация раствора NaCl (ρ=1,13 г/мл) составляет 5,28М. Определите процентную концентрацию (%) данного раствора. 27,34 -
При изменении давления происходит изменение растворимости газов в крови, что может привести к возникновению тяжелыхзаболеваний. Укажите, как изменится растворимость газов в крови при увеличении давления: Возрастает -
Растворперманганатакалия в зависимости от концентрации оказывает вяжущее, раздражающее или прижигающее действие. Определите массовую долю данного раствора (%), если 50г вещества растворено в 250мл воды. 16,7 -
Необходимо приготовить 40% раствор бромида калия. Укажите классификацию данного раствора в зависимости от концентрации ионов водорода и содержания растворенного вещества: Нейтральный, концентрированный -
При растворении 24,0г калия хлорида в 100мл воды (при 20оС), была получена система, которая находится в равновесном состоянии с растворенным веществом. Определите тип данного раствора: Насыщенный -
В медицинской практике широко применяют 10 % гипертонический раствор СаСl2.. Определите, какое количество граммов соли нужно растворить в 200 мл воды, чтобы получить раствор с заданной концентрацией: В медицинской практике широко применяют 10 % гипертонический раствор СаСl2.. Определите, какое количество граммов соли нужно растворить в 200 мл воды, чтобы получить раствор с заданной концентрацией: 22,2г -
При охлаждении насыщенного раствора произошло выделение растворённого вещества. Укажите название данного процесса. Кристаллизация -
Процентная концентрация раствора NаNO3 (ρ=1,13 г/мл) составляет 23%. Определите молярную концентрацию (моль/л) данного раствора. 3,06 -
Необходимо приготовить раствор перманганата калия КMnO4. Укажите процесс, приводящий к повышению растворения данной соли: Повышение температуры -
В качестве наружного средства при воспалении слизистых оболочек и конъюктивитах применяют 0,25% раствор CuSO4. Определите массу соли в граммах, необходимую для приготовления 200г данного раствора0,50 -
Растворы 0,1—0,25% сульфата цинка угнетают размножение микроорганизмов и, взаимодействуя с тканевыми белками, оказывают вяжущее и противовоспалительное действие; их применяют в виде глазных капель в офтальмологии. Определите массу вещества в граммах, необходимую для приготовления 50 г0,25% раствора: 0,505 -
Значительное количество лекарственных средств вводится в организм больных в виде растворов. Укажите фактор, приводящий к повышению взаимного растворения жидкостей: Повышение температуры -
Необходимо приготовить 0,2% раствор Na2HPO4. Укажите тип данного раствора в зависимости от концентрации ионов водорода и содержания растворенного вещества в нем: Кислый, разбавленный
"Растворы. Перманганатометрия как метод объемного количественного анализа.
-
В зависимости от типа химических реакций, которые лежат в основе количественных определений, титриметрические методы анализа подразделяются на несколько основных типов. Укажите, к какому типу относится метод перманганатометрии: Метод оксидиметрии; -
В клинической лаборатории проводили определение в крови ионов кальция методом перманганатометрического титрования. Укажите соединение, которое необходимо использовать для создания необходимого значения рН среды в данном методе анализа: H2SO4 -
В одном из методов титриметрического анализа в качестве вещества-окислителя используют дихромат калия K2Cr2O7. Укажите степень окисления хрома в данном соединении: +6; -
В основе качественного и количественного анализа лежат окислительно-восстановительные реакции. Укажите характеристику, изменение которой всегда происходит при протекании данных реакций: Степень окисления -
В титриметрическом анализе важное значение имеет понятие молярной массы эквивалента.Укажите, чему равна данная величина (г/моль) для Аl(NO3)3 . 71 -
Для проведения перманганатометрического титрования необходимо приготовить 500 мл рабочего раствора KMnO4 с молярной концентрацией эквивалента 0,2 моль экв/л. Определите в граммах массу веществаKMnO4: 3,16; -
Для количественного определения пероксида водорода в таблетках «Гидроперит» фармацевту необходимо приготовить 0,01 н раствор перманганата калия. Укажите формулу, которой он может воспользоваться для расчета массы вещества: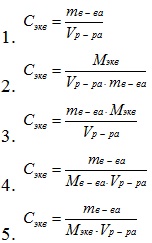
-
Для проведения анализа необходимо приготовить 0,1 моляльный раствор хлорида кальция. Укажите единицы измерения данной концентрации: моль/кг; -
Для проведения перманганатометрического титрования необходимо приготовить 300 мл раствора KMnO4 с молярной концентрацией эквивалента 0,4 моль экв/л. Определите массу навески перманганата калия в граммах: 3,79; -
Концентрация приготовленного раствора указывает число моль-эквивалентов растворенного вещества, содержащиеся в 1000 мл раствора. Укажите тип данной концентрации: Нормальная -
Марганец (Mn) – элемент с переменной валентностью. Укажите, чему равна степень окисления этого элемента в сульфате марганца MnSO4 . + 2; -
Марганец образует ряд оксидов. Укажите соединение, у которого наиболее ярко выражены основные свойства: MnO -
Метод перманганатометрии предусматривает применение растворов с точной молярной концентрацией эквивалента. Укажите посуду, которую используют для приготовления данных растворов: Мерные колбы; -
Метод перманганатометрии предусматривает титрование в кислой среде. Укажите, почему для создания данной среды нельзя использовать азотную кислоту. Является сильным окислителем; -
О способности веществ проявлять окислительно-восстановительные свойства можно судить по степени окисления атомов элементов, входящих в данное вещество. Укажите соединение, обладающее окислительно – восстановительной двойственностью: Na2SO3 -
Окончание титрования в методе перманганатометрии определяют по точке эквивалентности. Укажите способ определения этой точки в данном методе анализа: Появление розовой окраски; -
Определение окисляемости воды проводят методом перманганатометрического титрования. Укажите одно из условий проведения данного метода титрования: Кислая среда; -
Перманганат калия применяют в медицинской практике как бактерицидный препарат. Укажите химические свойства, которые обуславливают его антимикробную активность: Окислительные; -
Перманганат калия, обладающий противомикробным действием, находит широкое применение в медицине. Укажите (в %) массовую долю данногосоединения в растворе, применяемого для обработки язв и ожогов: 5,0 -
При расчете молярной концентрации эквивалента растворенного вещества используют фактор эквивалентности. Укажите, чему он равен для соединения Al2(SO4)3: 1/6 -
При определении концентрации вещества методом перманганатометрии необходимо приготовить 200 мл раствора KMnO4 с молярной концентрацией эквивалента 0,1 моль-экв/л. Определите массу навескиKMnO4 в граммах: 0,63; -
При проведении перманганатометрического анализа студент должен установить титр рабочего раствора перманганата калия. Укажите единицы измерения данной величины: г/мл; -
При решении задачи возникла необходимость найти массу вещества, исходя из молярной концентрации эквивалента. Укажите формулу, которую можно применить для расчета: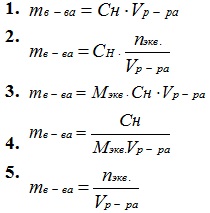
-
При титровании методом перманганатометрии необходимо учитывать кислотность среды. Укажите, почему данный метод анализа нежелательно проводить в нейтральной среде: Образуется бурый осадо -
Продукты восстановления калия перманганата зависят от характера среды. Укажите среду, в которой проводят титрование в перманганатометрии: Сильнокислая -
Рабочий растворKMnO4 по точной навеске кристаллического препарата приготовить невозможно, так как в нем всегда содержатся примеси. Укажите соединение, используемое для определенияточной концентрации раствора перманганата калия: Щавелевая кислота -
Среди соединений хлора укажите вещество, обладающее наиболее ярко выраженной окислительной активностью: НClО4 -
Студент получил задание: для проведения перманганатометрического титрования приготовить 100 мл раствора KMnO4 с молярной концентрацией эквивалента 0,5 моль/л. Определите в граммах массу веществаKMnO4: 1,58; -
Титрование в методе перманганатометрии проводится в кислой среде. Укажите, почему для этой цели не используют раствор НСl; Проявляет восстановительные свойства; -
Титрованный раствор калия перманганата по точной навеске кристаллического препарата приготовить невозможно. Укажите причину данного явления: Содержит примеси; -
Укажите кислоту, которую используют в перманганатометриидля поддержания нужного уровня рН: H2SO4 -
Кислотно-основное равновесие в организме. Водородный показатель
-
Значение рН желудочного сока приблизительно равно 2. Определите концентрацию гидроксильных ионов (моль/литр) в данной биологической среде. [OH ] = 10 12; -
У больного рН мочи равно 5,1. Укажите, какой цвет примет лакмусовая индикаторная бумага в данной биологической жидкости. Красный; -
При изменении кислотно-основного состоянияорганизмаможитразвиться алкалоз. Укажитераствор, которыйнеобходимоприменить напервойстадиилечения. 5% p-p аскорбиновой кислоты; -
Молярная концентрация водородных ионов [Н+] составляет 1,0∙10 - 8 моль/л. Определите рН данного раствора. 4, среда щелочная;, 8, среда кислая;, 9, среда щелочная;, рН, 8, среда щелочная;, 6, среда кислая -
При нарушении кислотно-щелочного баланса в организме может развиться ацидоз. Укажите изменения, которые будут при этом происходить в крови. Уменьшение рН крови. -
В растворах имеет место кислотно-основное равновесие, обусловленное переносом протона. Укажите, согласно протолитической теории, название веществ, которые являются донорами протонов. Кислоты -
Для выражения кислотности среды используют водородный показатель. Укажите определение, которое характеризует данную величину. Отрицательный десятичный логарифм концентрации ионов водорода; -
Согласно протолитической теории Бренстеда-Лоури, кислоты - это доноры протонов, а основания - акцепторы протонов. Укажите сопряженную кислоту и сопряженное основание в следующем примере: -
NH3 + H2O ↔ NH4+ + OH- . NH4+- сопряженная кислота, OH- - сопряженное основание -
Часто вместо абсолютных значений молярной концентрации ионов H+ пользуются водородным показателем. Укажите математическое выражение данной величины. рН = -lg [Н+] ; -
Величина, связывающая между собой концентрации водородных и гидроксильных ионов, называется ионное произведение воды. Укажите уравнение, описывающее данную характеристику. Kw = [H+] [OH]; -
Вода - слабый электролит. Укажите, чему равна ее константа диссоциации при 22 оС: 10 -16. -
При диагностике заболевания необходимой частью анализа биологических жидкостей является определение рН. Укажите название инструментального средства, с помощью которого определяют данный показатель. Иономер; -
Вода является слабым электролитом и диссоциирует по следующей схеме: Н2О ↔ H+ + OH-. Укажите определение, характеризующее ионное произведение воды. Произведение концентраций ионов водорода и гидроксил-ионов; -
Согласно протолитической теории Бренстеда-Лоури, кислоты - это доноры протонов, а основания - акцепторы протонов. Укажите сопряженную кислоту и сопряженное основание в следующем примере: -
СН3СООН + H2O ↔ СН3СОО - + H3O+ . H3O+- сопряженная кислота, СН3СОО- - сопряженное основание; -
Активность ферментов слюны находится в определенном интервале значений рН. Укажите диапазон рН, в котором наиболее активны ферменты данной биологической жидкости. 6,35-6,85; -
Концентрация ионов гидроксила в исследуемом растворе равна 1·10-12моль/л. Укажите рН раствора и характер среды. 12, среда щелочная;, 2, среда слабощелочная;, 12, среда слабощелочная;, pH, 2, среда сильнокислая;, 2, среда слабокислая -
Концентрации [H+] и [OH-] в растворе ] величины сопряженные. Укажите уравнение, связывающее эти показатели при 22 С. [Н+] · [ОН] = 10 -14 . -
При сильной рвоте изменяется рН крови, что приводит к возникновению алкалоза. Укажите рН крови, характерное для данной патологии. 7,00 -
Тканевыекатепсины катализируют синтез белков при рН=7. Определите, кислотность среды, которая отвечает данному значению рН. Нейтральная; -
Для размножения холерных эмбрионов оптимум рН лежит в пределах 8,3-9,4. Укажите, какая среда отвечает данному значению рН. Щелочная;


