ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 36
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Буферные растворы
-
При работе в лаборатории для поддержания рН студенты использовали формиатную буферную систему. Укажите компоненты, которые входят в ее состав. HCOOH + HCOONa; -
При выборе буферной системы с нужным значением рН основную роль играет рКд слабого электролита. Укажите, при каком условии рН= рКд слабого основания, которое входит в состав буферного раствора. Правильные ответы: Соотношение Соснования: Ссоли в составе буферного раствора равно 1;, Н2PO4 –; Na +; НPO4 2–; -
При проведении исследований необходимо было подобрать основный буфер с диапазоном рН 8,4-10,3. Укажите, какую из перечисленных ниже систем выберут для работы: Аммонийная; -
Буферные системы поддерживают рН крови на постоянном уровне при добавлении небольших количеств сильных кислот и оснований, а так же при концентрировании и разбавлении. Укажите возможные составляющие данных систем. Слабая кислота и ее соль с сильным основанием; -
При работе в лаборатории для поддержания рН студенты использовали ацетатную буферную систему. Укажите компоненты, которые входят в ее состав: CH3COOH + CH3COONa; -
Гидрокарбонатная буферная система является одной из основных буферных систем крови. Укажите, почему при добавлении к данному буферному раствору определенного количества КОН, рН не изменяется. КОН заменяется эквивалентным количеством воды; -
Ацетатный буфер позволяет регулировать концентрации ионов водорода и гидроксид-ионов. Укажите рН ацетатного буфера, если соотношение компонентов Ссоли : Скислоты = 2 : 1 (рКа уксусной кислоты = 4,8; lg 2 =0,3). 5,1; -
Фосфатная буферная система входит в состав буферных систем организма. Укажите, почему при добавлении к данному буферному раствору определенного количества HCl, рН не изменяется. HCl заменяется эквивалентным количеством NaH2РO4; -
В биохимических лабораториях часто используют бикарбонатную буферную систему. Укажите частицы, которые содержатся в данном буферном растворе. НСO3 –; СO32–; Na + ; Н+ -
В лаборатории имеется несколько ацетатных буферных систем с различным содержанием компонентов. Укажите, какой из них обладает наибольшей емкостью. 50 мл 0,1 М р-ра кислоты и 50 мл 0,1 М р-ра соли -
При работе в лаборатории для поддержания рН студенты использовали аммонийную буферную систему. Укажите компоненты, которые входят в ее состав. NH3 ·H2О + NH4Cl; -
При проведении клинического анализа крови пациента после длительного голодания, было определено рН плазмы, которое составило 7,3.Определите кислотно-основное состояние крови по данному показателю. Ацидоз; -
Кислотно-щелочное состояние организма оценивается с помощью уравнения Гендерсона-Гассельбаха. Укажите, какую величину позволяет определить данное уравнение: рН буферной системы; -
В лаборатории для работы необходимо было подобрать кислотный буфер с диапазоном рН 3,7-5,6. Укажите, какую из перечисленных ниже систем выберут для работы. Ацетатная; -
В биохимических исследованиях часто применяют ацетатную буферную систему. Укажите частицы, которые содержатся в данном буферном растворе. СН3СОО–; Н+ ; Na +; -
В крови, моче, пищеварительных соках содержится фосфатный буфер, который имеет значение рН от 5,9 до 7,8, в зависимости от соотношения компонентов. Укажите, какие компоненты могут образовывать данный буфер. NaH2PO4 и Na2HPO4; -
Самыми мощными буферными системами крови являются гемоглобиновая и оксигемоглобиновая. Укажите, с каким свойством гемоглобина связано его буферное действие. Со способностью проявлять свойства кислот; -
В клинике при анализе крови зачительный интерес представляет экспериментальное определение содержания СО2 в крови. Укажите в каком виде содержится данный ион в крови. Растворимые гидрокарбонаты – HCO3 –; -
Фосфатная буферная система является одной из буферных систем организма. Укажите, почему при добавлении к данному буферному раствору определенного количества NaОН, рН системы не изменяется. Избыток ионов ОН– связывается в воду -
рН плазмы крови имеет постоянное значение – 7,36, которое обеспечивается бикарбонатным буфером крови. Пользуясь формулой Гендерсона-Хассельбаха, рассчитайте соотношение компонентов Ссоли : Скислоты в гидрокарбонатном буфере, если рН=7,6 (рКа угольной кислоты = 6,6). 10 : 1; -
Студенту необходимо рассчитать рН гидрокарбонатного буфера, воспользовавшись уравнением Гендерсона-Хассельбальха, при соотношении компонентов Ссоли : Скислоты = 2 : 1 (рКа угольной кислоты = 6,1; lg 2 =0,3). Укажите правильный ответ: 6,4; -
Лаборанту необходимо приготовить 50 мл ацетатного буфера, обладающего наибольшей буферной емкостью. Укажите соотношение компонентов, которое он выберет для приготовления данной буферной системы. 25 мл 0,2 М р-ра кислоты и 25 мл 0,2 М р-ра соли; -
В клинике при анализе крови значительный интерес представляет определение резервной щелочности крови. Укажите определение, характеризующее данный показатель. Количество мл СО2 в 100мл плазмы крови; -
Очень важной буферной системой организма является гидрокарбонатная система. Укажите компоненты, которые входят в ее составH2CO3 + NaHCO3; -
Для поддержания постоянным рН раствора в лабораториях применяют ацетатный буфер. Укажите, почему при добавлении к данной буферной системе определенного количества сильной кислоты HCl рН раствора не изменяется. HCl заменяется эквивалентным количеством СН3СООH; -
Фосфатная буферная система входит в состав буферных систем организма. Укажите ионы, которые содержатся в данном буферном растворе. Н2PO4 –; Na +; НPO4 2–; -
На лабораторно-практическом занятии проводилось определение рН буферных систем и сравнение полученных показателей с расчетными данными. Укажите уравнение Гендерсона-Хассельбаха, которое необходимо применить для фосфатного буфера.
-
Студенты на занятии готовили аммонийные буферные растворы с заданным значением рН и сравнивали полученные показатели с расчетными данными. Укажите уравнение Гендерсона-Хассельбаха, которое необходимо применить для расчетов.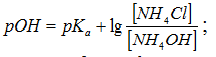
-
Студенту при решении задачи необходимо рассчитать буферную емкость. Укажите, формулу позволяющую рассчитать данную величину.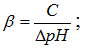
-
Уравнение Гендерсона-Хассельбальха применяется для определения рН буферной системы, а так же для расчета количества компонентов при приготовлении буферных растворов по заданному значению рН. Укажите, какой вид имеет данное уравнение для бикарбонатного буферного раствора.
-
Коллигативные свойства растворов. -
В хирургии для очищения гнойных ран используют марлевые повязки, смоченные в растворе NaCl. Укажите процентную концентрацию раствора, который может быть использован при этом. 10. -
При работе в лаборатории необходимо было рассчитать повышение температуры кипения разбавленного раствора электролита NaNO3. Укажите формулу, необходимую для расчета. Δtкип. = 2ЕСm. -
В клинической практике при больших кровопотерях больному вводят физиологические растворы. Укажите данный раствор. 5,0% раствор глюкозы; -
При помещение клеток в гипертонический раствор наблюдается их сморщивание. Укажите, как называется это явление. Плазмолиз; -
В клинической лаборатории проводили определение молекулярной массы растворенного вещества, измерив температуру замерзания раствора и растворителя. Укажите методом, каким воспользовались при этом определенииКриометрия; -
При помещении эритроцитов в раствор, изотоничный крови, сохраняется их нормальное состояние. Укажите раствор изотоничный крови. 5 % глюкозы; -
Для определение чистоты органических веществ, используя криометрический метод, основанный на измерении температуры замерзания растворов. Укажите фактор, от которого зависит криоскопическая константы в данном методе. Природы растворителя; -
При определении молекулярной массы вещества необходимо рассчитать понижение температуры замерзания раствора электролита. Укажите формулу для расчета. Δtзам. = iKCm; -
В биохимических исследованиях понижение температуры замерзания крови называют «депрессией». Укажите определение, характеризующее данное понятие. Понижение температуры замерзания плазмы крови по сравнению с водой; -
В медицинской практике при сильном обезвоживании больному вводят физиологические растворы. Укажите данный раствор. 0,85-0,9% раствор NaCl; -
Для расчета осмотического давления растворов электролитов используется изотонический коэффициент і.. Укажите формулу для его расчета. i = 1 + α (β - 1) -
Для расчета осмотического давления плазмы крови вводится изотонический коэффициент. Укажите фактор, от какого он зависит. Степень диссоциации растворенного вещества; -
Действие слабительных - горькой соли MgSO4•7H2O и глауберовой соли Na2SO4•10H2O основано на определенном физико-химическом явлении. Укажите его. Осмос; -
Перемещение веществ в клетку и из нее осуществляется при помощи осмоса. Укажите, что является причиной возникновения этого явления. Два раствора с разной концентрацией, разделенные полупроницаемой мембраной; -
При работе в лаборатории необходимо было рассчитать повышение температуры кипения разбавленного раствора электролита NaCl. Укажите формулу, необходимую для расчета. 3 -
Измерение осмотического давления осуществляется определенным прибором. Укажите название этого прибора. Осмометр; -
При изучении явления гемолиза помещали эритроциты в растворы с различной концентрацией хлорида натрия. Укажите процентную концентрацию раствора, в котором будет наблюдаться данное явление. 0,2; -
Осмотическое давление крови человека при 37°С имеет определенное значение. Укажите это значение в атмосфера. 7,7; -
При изучении явления плазмолиза проводилось погружении эритроцитов клетки в растворы с различной концентрацией хлорида натрия. Укажите процентную концентрацию раствора, в котором будет наблюдаться данное явление. 3,5 -
При работе в лаборатории необходимо было рассчитать повышение температуры кипения разбавленного раствора электролита Na2SO4. Укажите формулу, необходимую для этого расчетаΔtкип. = 3ЕСm;
Осмос и осмотическое давление
-
Криометрический метод основан на измерении температуры замерзания растворов. Укажите фактор, от которого зависит криоскопическая константы в данном методе. Природы растворителя; -
Явление осмоса широко применяется в медицинской практике. Укажите, каким раствором смачивается марля, которую вводят в гнойные раны. Гипертоническим; -
Для очищения гнойных ран используют марлевые повязки, смоченные раствором NaCl. Укажите процентную концентрацию раствора, который может быть использован при этом. 10. -
При погружении эритроцитов клетки в растворы с различной концентрацией хлорида натрия в одном из растворов наблюдается явление плазмолиза. Укажите процентную концентрацию раствора, в котором будет наблюдаться данное явление. 4,5 -
Метод эбулиометрии основан на измерении температуры кипения раствора и растворителя. Укажите фактор, от которого зависит эбулиоскопическая константа в данном методе. Природы растворителя; -
Осмотическое давление крови человека при 37°С имеет определенное значение. Укажите это значение в атмосферах. 7,7; -
При определении молекулярной массы вещества необходимо рассчитать понижение температуры замерзания раствора неэлектролита. Укажите формулу для расчета.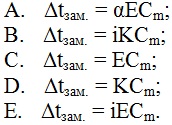
-
Для расчета осмотического давления растворов электролитов используется изотонический коэффициент і.. Укажите формулу для его расчета.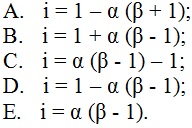
-
При помещение эритроцитов в гипертонический раствор наблюдается их сморщивание. Укажите, как называется это явление. Плазмолиз; -
ля возникновения явления осмоса необходимы определенные условия. Укажите, что является причиной возникновения этого явления при наличии двух растворов: С разной концентрацией, разделенные полупроницаемой мембраной; -
"Комплексообразование в биологических системах " -
В комплексном соединении комплексообразователь с лигандом образует строго определенное число связей. Укажите название данного свойства комплексообразователя. Координационное число -
Формула комплексного соединения имеет вид: [K2[HgСl4]. Определите величину координационного числа комплексообразователя в данном соединении, если Cl- - монодентатный лиганд4; -
При кипячении водопроводной воды на дне колбы образовался осадок солей. Определите характер образовавшегося осадкаCaCO3 + MgCO3; -
Константа нестойкости (Кн) - константа диссоциации комплексного иона. Укажите фактор, который характеризует данная константа. Устойчивость комплексного иона к диссоциации; -
Для определения ионов металлов методом комплексонометрии применяют динатриевую соль этилендиаминтетрауксусной кислоты (трилон Б). Определите дентатность данного лигандаКовалентная (иногда ионная) и координационная; -
Временная жесткость воды обусловлена присутствием солей, которые разлагаются при кипячении. Укажите формулу одной из таких солей. 1; -
Полидентатные лиганды входят в состав многих биологически важных циклических комплексов: хлорофилл, гем гемоглобина, витамин В12 и др. Укажите один из таких лигандов. ЭДТА; -
Гем гемоглобина – бионеорганическое соединение с макроциклическим лигандом порфирином. Укажите ион, который является комплексообразователем в данном соединении. Fe2+; -
При определении общей жесткости воды методом комплексонометрии установлено, что водопроводная вода мягкая. Укажите нормативное значение жесткости (ед), которому соответствует данная вода. 2- -
Внутренняя сфера комплексного соединения имеет вид: [Co(NH3)6]3+. Определите характер связи между центральным атомом и лигандами в данном комплексном ионе. Ковалентная полярная (по донорно-акцепторному механизму)
Адсорбция
-
Коллоидные растворы обладают поверхностной энергией. Укажите, от чего зависит эта энергия. Величины площади раздела фаз;
-
В соответствии с общей терминологией по сорбции существуют понятия адсорбент и адсорбтив. Укажите, какое вещество называют адсорбентом: На поверхности которого адсорбируется другое вещество.
-
Избирательность адсорбции заключается в том, что ионы по-разному адсорбируются. Укажите, какой из приведенных ионов обладает наибольшей адсорбционной способностью. Al3+. -
Вещества бывают поверхностно-активные и поверхностно-инактивные. Укажите поверхностно- инактивное вещество: Сахароза. -
Правило Дюкло-Траубе позволяет оценить поверхностную активность в ряду карбоновых кислот. Укажите, какая из указанных кислот имеет наиболее высокую поверхностную активность. C4H9COOH. -
В медицинской практике применяются катионообменные смолы. Укажите где их используют: Для декальцинирования крови с целью ее консервирования. -
Для очистки воды применяются ионообменные смолы (ионообменники). Укажите, от какого иона можно очистить воду с помощью анионитов: ClC -
Поверхностно-активные вещества определенным образом влияют на поверхностное натяжение раствора. Укажите, какие вещества называются поверхностно-активными. Уменьшающие поверхностное натяжение раствора; -
Правило Пескова-Фаянса иллюстрирует избирательность ионной адсорбции. Укажите, какие ионы будут адсорбироваться на кристаллической поверхности частиц AgI, образованных при взаимодействии AgNO3 + KI.
II u Ag+
-
Поверхностное натяжение раствора зависит от определенного фактора.
Укажите, этот фактор: Концентрации растворенного вещества. -
Строение молекул поверхностно-активных веществ имеет важнейшую особенность. Укажите ее: Наличие полярной группы и неполярного углеводородного радикала. -
В соответствии с общей терминологией по сорбции существуют понятия адсорбент и адсорбтив. Укажите, какое вещество называют адсорбтивом. Которое адсорбируется на поверхности другого вещества; -
Вещества бывают поверхностно-активные и поверхностно-инактивные. Укажите поверхностно-активное вещество:
Пентанол.
-
Ученый Гиббс вывел уравнение, связывающее поверхностную активность вещества и его концентрацию. Укажите, что можно рассчитать по уравнению Гиббса: Величину адсорбции на поверхности жидкости. -
Некоторые вещества создают небольшое поверхностное натяжение при добавлении их к воде. Укажите их: Жирные кислоты. -
Поверхностно-инактивные вещества имеют определенное поверхностное натяжение. Укажите среди приведенных ниже веществ такое вещество: Серная кислота. -
Для очистки воды применяются ионообменные смолы (ионообменники). Укажите, от какого иона можно очистить воду с помощью катионитов: Na+ -
Адсорбция различных веществ в крови и протоплазме клеток имеет большое значение для обмена веществ в живых организмах. Укажите, что происходит при этом явлении: Накопление одного вещества на поверхности другого; -
Поверхностное натяжение биологических жидкостей используется в диагностических целях. Укажите, где возникает поверхностное натяжение. На поверхности раздела фаз. -
Положительная адсорбция имеет большое значение для обмена веществ в живых организмах. Укажите вещество, которое может создавать такую адсорбцию. Пентанол. -
Поверхностное натяжение играет значительную роль в таких явлениях как деление клеток, фагоцитоз. Укажите метод, который используется для определения поверхностного натяжения: Сталагмометрия; -
Избирательная адсорбция имеет большое практическое значение. Укажите, какой из ниже приведенных ионов обладает наибольшей адсорбционной способностью: PO433. -
Разные вещества могут положительно или отрицательно адсорбироваться при добавлении их к воде. Укажите вещество, которое отрицательно адсорбируется. Хлорид натрия; -
Определенные жидкости имеют различное поверхностное натяжение. Укажите, какая жидкость создает наибольшее поверхностное натяжение на границе с воздухом: Вода. -
Поверхностно-инактивные вещества определенным образом влияют на поверхностное натяжение воды. Укажите, как ведут себя поверхностно-инактивные вещества при добавлении их к воде: Практически не изменяют поверхностное натяжение; -
Многие вещества положительно адсорбируются. Укажите, что происходит при положительной адсорбции растворенного вещества в растворе. Концентрация вещества на поверхности раствора больше, чем внутри; -
Избирательность адсорбции заключается в том, что ионы по-разному адсорбируются. Укажите, какой из приведенных ионов обладает наибольшей адсорбционной способностью: AsO433. -
Многие вещества относятся к поверхностно-активным. Укажите такое вещество: C17H35COONa. -
Правило Пескова-Фаянса иллюстрирует ионную адсорбцию. Укажите, какие ионы будут адсорбироваться на частицах ВaSO4, образованных при взаимодействии Н2SO4 + BaCl2.
Ba 2+ и SO422.
-
Поверхностное натяжение раствора можно увеличить определенным образом. Укажите, как можно это сделать: Увеличить концентрацию растворенных веществ.
Дисперсные системы
-
Большинство биологических водных растворов представляют собой системы, в которых одно вещество, находящееся в раздробленном виде, равномерно распределено в общей массе другого. Дайте название данному понятию. Дисперсная система -
В фармации многие лекарственные формы представляют собой коллоидные растворы (золи). Укажите метод, с помощью которого можно получить данные растворы Пептизация -
Взвесь глины в воде представляет собой гетерогенную дисперсную систему. Укажите тип данной дисперсной системы Суспензия -
Диализ это физико-химический метод, широко применяемый в химии дисперсных систем. Что такое диализ? Очистка золя от посторонних примесей молекул или ионов -
Для временной замены функции почек при острой почечной недостаточности применяется аппарат “искусственная почка”. Укажите метод очистки золей, на котором основан принцип действия данного аппарата. Компенсационный диализ -
Для диспергирования более крупных частиц до желаемой степени дисперсности используют определенный метод. Укажите этот метод. Использование коллоидных и шаровых мельниц -
Для коллоидных растворов также как и для истинных растворов характерны определенные молекулярно-кинетические явления. Выберите одно из них: Броуновское движение -
Для коллоидных растворов и истинных растворов характерны молекулярно-кинетические свойства. Выберите свойство, которое роднит коллоидные и молекулярные растворы: Осмотическое давление -
Для коллоидных растворов характерны специфические молекулярно-кинетические явления. Определите одно из таких явлений. Опалесценция -
Для лечения детских инфекций применяются антибиотики в форме суспензий. Определите степень дисперсности (см) данных дисперсных систем и группу, к которым они относятся. Грубодисперсные системы -
Для получения золей с наибольшей устойчивостью необходимо удаление из золей избытка электролитов, которые, как правило, образуются при получении золей. Среди перечисленных физико-химических методов укажите метод очистки золя:


