Файл: Щербакова Лидия Евгеньевна Портфолио слушателя Раздел В.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 4
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Щербакова Лидия Евгеньевна Портфолио слушателя Раздел В
Филиал ЧУ «ЦПМ» Курсы по «Разработке и экспертизе
г. Петропавловск заданий для оценивания»
Раздел В
Задания по суммативнному оцениванию за 1 четверть
Продолжительность – 40 минут
Количество баллов – 25
Типы заданий:
МВО – задания с множественным выбора ответа
КО – задания , требующие краткого ответа
РО – задания, требующие развернутого ответа
Структура суммативного оценивания
Данный вариант состоит из 12заданий . включающий задания с множественным выбором ответов, с кратким и развернутым ответами.
В вопросах требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения.
В вопросах требующих развернутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла.
Задание может содержать несколько структурных частей /подвопросов
Характеристика заданий суммативного оценивания за 1 четверть
| Раздел | Проверяемые цели | Уровень мыслительных навыков | Кол. зада-ний* | № зада-ния* | Тип зада ния* | Время на выполнения,мин* | Балл* | Балл за раздел |
| 8.1 А Движение электронов в атоме | 8.1.3.1-понимать, что электроны в атомах распределяются последовательно по энергетическим уровням на возрастание расстояния от ядра | Знание и понимание | 2 | 1,2 | МВО | 2 | 2 | 8 |
| 8.1.3.4 -уметь писать электронные конфигурации и электронно-графические формулы первых 20 химических элементов | Применение | 1 | 3 | РО | 4 | 2 | ||
| 8.1.3.5 -понимать, что атомы могут принимать или терять электроны, что приводит к образованию ионов | Знание и понимание | 1 | 4 | МВО | 4 | 2 | ||
| 8.1.3.6 -составлять формулы соединений методом «нулевой суммы» | Применение | 1 | 5 | КО | 4 | 2 | ||
| 8.1В Формулы веществ и уравнения химических реакций | 8.2.3.1 -вычислять массовые доли элементов в составе вещества, выводить формулы веществ по массовым долям элемента | Применение | 1 | 6 | РО | 6 | 4 | 8 |
| 8.2.3.3 -составлять уравнения химических реакций, записывая формулы реагентов и продуктов реакции | Применение | 1 | 7 | МВО | 4 | 2 | ||
| 8.2.2.1- классифицировать химические реакции по числу и составу исходных и образующихся веществ | Знание и понимание | 1 | 8,9 | КО | 4 | 2 | ||
| 8.1С Сравнение активности металлов | 8.2.4.3 –исследовать факторы, влияющие на возникновение коррозии | Навыки высокого порядка | 1 | 10 | РО | 4 | 3 | 9 |
| 8.2.2.5 – составлять уравнения реакций металлов с кислотами | Применение | 1 | 11 | КО | 4 | 3 | ||
| 8.2.4.8 – прогнозировать возможность протекания незнакомых реакций замещения металлов, используя ряд активности металлов | Навыки высокого порядка | 1 | 12 | РО | 4 | 3 | ||
| | Всего баллов | | | | | 40 | 25 | 25 |
Задания суммативного оценивания за 1 четверть по предмету «Химия»
-
Определите неверные электронные конфигурации элементов
-
1s2 -
1s21р1 -
1s22s1 -
1s22s22р -
1s22s22р7 -
1s22s22р5
[1]
2. Определите какому элемент периодической таблицы химических элементов принадлежит данная электронная конфигурация: 1s22s22p2
-
Калий -
Алюминий -
Углерод -
Фосфор
[1]
3. Напишите электронную конфигурацию и электронно-графическую формулу атома, используя ответ задания № 2
| |
[2]
4. Соотнесите формулы ионов с числом электронов в них
| Формулы ионов | Число электронов |
| А. Са+2 | 1. 15ẽ |
| В. О-2 | 2. 18 |
| С. Li+ | 3. 10 |
| D. Р0 | 4. 2 |
| А | В | С | D |
| | | | |
[2]
-
5. Используя метод «нулевой суммы» докажите , что N2O5 и NO имеют одинаковый заряд иона азота:
_____________________________________________________________
[2]
6. а) Вычислите массовую долю алюминия, в его оксиде Al2О3
| |
[2]
б) Расчитайте формулу оксида серы, если ее содержание в соединении составляет 50%
| |
[2]
7. Заполните недостающие фрагменты уравнений реакций с учетом коэффициентов
Zn + …. → ZnCl2+H2
С+ О2 →…..
[2]
8. Установите соответствие между типами реакций их примерами
|
|
|
|
|
|
|
|
Ответ:
| 1 | 2 | 3 | 4 |
| | | | |
[1]
9
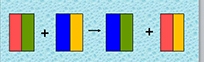 . Определи, к какому типу реакции относиться изображенная схема, напиши пример уравнения данной реакции
. Определи, к какому типу реакции относиться изображенная схема, напиши пример уравнения данной реакции _________________________________________________________________
[1]
1
 0. Рассмотрите картинку, назовите процесс, который происходит с железными изделиями, укажите не менее трех причин происходящего процесса
0. Рассмотрите картинку, назовите процесс, который происходит с железными изделиями, укажите не менее трех причин происходящего процесса__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ [3]
11. Заполните таблицу, укажите продукты реакции взаимодействия металла с кислотой
| | H3PO4 | H2SO4 | H2S |
| Li | | | |
| Mg | | | |
[3]
11. Для исследования активности мeталлов, провeдём опыт, помeстим Ni в предложeнные растворы:
а) Заполните таблицу , поставив «+» где возможны реакции,
«-» реакции не осуществимы
| | HCl | H2O (t) | Pb(NO3)2 | Na2SO4 |
| Ni | | | | |
[1]
б) Объясните свойства никеля используя данные таблицы
________________________________________________________________.
________________________________________________________________[2]
Схема выставления баллов
| № | Ответ | Балл | Дополнительная информация | ||||||||||||||||||||
| 1 | ВЕ | 1 | | ||||||||||||||||||||
| 2 | С | 1 | | ||||||||||||||||||||
| 3 | Углерод 1s22s22р2
| 1 1 | | ||||||||||||||||||||
| 4 |
| 2 | 1 балл за каждые 2 верных ответа | ||||||||||||||||||||
| 5 | N2+5O5-2 N+5O-2 | 1 1 | | ||||||||||||||||||||
| 6 | а) Mr(Al2O3) = 70 w = Ar*n/Mr W=27*2/102*100% = 53% б) 100% - 50% =50% содержание кислорода х:у =50/32 :50/16 =1:2 SO2 | 1 1 1 1 | | ||||||||||||||||||||
| 7 | Zn +2HCl → ZnCl2+H2 C+O2→CO2 | 1 1 | | ||||||||||||||||||||
| 8 |
| 1 | | ||||||||||||||||||||
| 9 | Реакция обмена 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 | 1 | | ||||||||||||||||||||
| 10 | Коррозия. 1.действие воды и воздуха, 2.микрорганизмов, 3.химических веществ | 1 2 | | ||||||||||||||||||||
| 11 |
| 3 | 1 балл за каждый правильный столбец | ||||||||||||||||||||
| 12 |
Цинк относится к металлам средней активности, стоит до водорода, поэтому он взаимодействует с соляной кислотой, водой, нитратом свинца, но не взаимодействует с сульфатом натрия , так как хром менее активнее натрия | 1 2 | | ||||||||||||||||||||
